三、教材分析(一般为 15~20 分钟)
此过程主要体现“启发性和因材施教”的教学原则。它是整节课的中心环节,是课堂教学成败的关键。在此过程中既要突出教师在课堂中“站得高, 看得远”胸怀全局的导作用,又不能搞“一言堂”、“满堂灌”。分析问题既要紧扣教材内容,又要高于教材,注意新旧知识的联系和重要概念、理论的复习巩固。
在分析《硫酸、硫酸盐》一课时,为了补充完善同学们回答的第 1 题, 我就和同学们分析教材中的第一句话:“硫酸在水溶液里很容易电离生成氢离子”即:
H2SO4==2H++SO42-
这里电离出的阳离子全部是氢离子,由于突出了“全部”二字,同学们就自然联想到并巩固了酸的定义,又懂得了硫酸是酸类,应具有酸的通性。接着又分析教材的第二句话:“硫酸除了具有酸的通性以外,还具有哪
些特性”。这里我在肯定同学们回答的答案是正确的之后,立即提出了“酸的通性有哪些?”的老问题,以巩固复习旧知识,让同学在多次反复的过程中,把新旧知识连成一个完整的有机整体。在重新讨论酸的通性时又根据以往的经验特别强调指示剂(石蕊液、甲基橙、酚酞)遇酸的颜色变化,以突出加深印象。
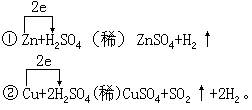 其次,同学在回答第
1
题时,答的“浓硫酸具有吸水性、脱水性、氧化性”。这些正是浓硫酸除有酸的通性外还具有的特性,但此答案是不完善的。因为教材是这样写的:“浓硫酸具有强烈的吸水性、脱水性和氧化性。”这里“强烈”二字非常重要,它既定吸水性,也定脱水性和氧化性。否则会引起理解错误,因为在
Zn+H2SO4(稀)==ZnSO4+H2↑的反应中,稀硫酸也是氧化剂,也具有氧化性。为进一步弄清氧化性性强弱的原因,又将教材第
65
页浓硫酸与金属铜反应和上述锌与稀硫酸反应的两个化学方程式进行对比分析(先演示实验后分析):
其次,同学在回答第
1
题时,答的“浓硫酸具有吸水性、脱水性、氧化性”。这些正是浓硫酸除有酸的通性外还具有的特性,但此答案是不完善的。因为教材是这样写的:“浓硫酸具有强烈的吸水性、脱水性和氧化性。”这里“强烈”二字非常重要,它既定吸水性,也定脱水性和氧化性。否则会引起理解错误,因为在
Zn+H2SO4(稀)==ZnSO4+H2↑的反应中,稀硫酸也是氧化剂,也具有氧化性。为进一步弄清氧化性性强弱的原因,又将教材第
65
页浓硫酸与金属铜反应和上述锌与稀硫酸反应的两个化学方程式进行对比分析(先演示实验后分析):
这里第①式反应实质是锌原子把电子转移给氢离子而本身被氧化变成锌离子,氢离子得到锌原子,提供的电子而被还原变成氢原子进而结合成氢分子。反应中具有氧化能力的是氢离子。第②式中则是铜把电子转移给硫酸根中正 6 价的硫原子,使之被还原为二氧化硫中正 4 价的硫。反应中具有氧化
能力的正 6 价的硫元素。由于稀硫酸和浓硫酸中被还原(具有氧化性)的元素及价态均不同,故稀硫酸具有氧化性,浓硫酸具有强氧化性。
在分析教材过程中有针对性地对重要的概念、定义进行仔细的推敲。这样一方面可让学生全面系统、准确的掌握新的知识。另一方面又培养了严密的科学思维和推理方法。通过较长时间的培养,学生能力提高很明显。
在此过程中,有时根据教材内容的需要也可补充一些利于突破重点、难点的关键的演示实验或学生实验来验证教材内容,铺之以对教材重点难点的突破。在此,在分析了浓硫酸的强氧化性后即补充了
①浓硫醚使蔗粮碳化的实验来验证浓硫酸的强脱水性。
②在加热和不加热条件下铝片与浓硫酸作用的现象来进一步证明浓硫酸的强氧化性。
③用亚硫酸钠分别与用硝酸酸化的硝酸钡和用盐酸酸化的氯化钡反应的现象来强调检验硫酸根离子应注意的事项,这样就使教材内容更加充实,开拓了教材的广度和深度。
