§9-4 化学基础理论教学示例高中化学中“共价键”的教学
一、地位和作用
原子结构、元素周期律和分子结构是高中化学中的重要理论。“共价键” 是分子结构理论的重要组成部分。共价键广泛地存在于非金属单质和共价化合物(特别是有机化合物)中,它是一种重要类型的化学键,因此,这一内容是物质结构的重要组成部分和有关章的重点教学内容之一。同时,由于共价键比离子键复杂,因而它也是教学的难点之一。
“共价键”这一内容是在初中化学已介绍过共价化合物概念和高中化学前段已介绍过有关原子结构、离子键理论知识的基础上提出来的,在此,扼要介绍有关共价键(包括配位键)的概念、形成过程和特性等初步知识。通过本节的教学,不但使学生获得了有关的新知识,还能使学生对已经学过的知识,如共价化合物的概念、核外电子的运动状态、能量最低原理、电子式等予以进一步运用、加深理解和巩固。
本节教材一开始就提出共价键是一种重要类型的化学键,提出讨论共价键的形成和性质这一问题。首先以氢分子的形成为例,运用电子配对法和电子云重叠的观点讨论共价键形成的过程、条件和实质,运用电子式、结构式表示氢分子中的共用电子对,运用电子云图象表示氢分子的形成。在此基础上,概括出共价键的定义,引出键长的概念。并通过氢分子形成的热化学方程式,推论并建立键能的概念,阐明键长、键能对键的强弱和对分子稳定性的影响。接着又运用电子式和结构式介绍了 Cl■、N■、HCl、H■O 共价分子, 巩固学过的电子配对法和共价键概念,以及熟练地掌握用电子式、结构式表示共价分子(共价键)的书写技能。再以硫化氢分子为例,根据共价键的形成条件,原子核外未成对的电子数,以及电子云的伸展方向等知识,讨论共价键的饱和性和方向性,并引出键角的概念,为以后讲极性分子、有机化合物分子结构打下基础。最后简单介绍配位键的概念,并以铵离子为例说明配位键的形成和条件,从而使学生对化学键的类型有较全面的了解,并为以后学习配合物打下基础。
二、教学目的
(一)使学生初步掌握共价键的概念、形成条件、实质和特性。初步理解键能、键长、键角等概念。
(二)初步了解配位键的概念。
(三)掌握用电子式、结构式表示共价分子的书写方式。三、教学重点
共价键的概念、形成条件、实质和特性。四、教学难点
共价键的实质。五、教法讨论
(一)突出重点和突破难点
以氢分子的形成为例,讨论共价键的形成过程、条件、实质和共价键的定义。这部分是本节教学的重、难点内容。从突出重点和突破难点来要求, 对这部分教材的教学应加强两个方面。
- 组织教材,加强教学内容的逻辑顺序。设计教学过程,使教学有层次
地提出矛盾,解决矛盾,对比分析,启发诱导学生的逻辑思维。具体教学过程,可按下列顺序进行。
(1)共价键是共价化合物分子中存在的一种化学键。因此,首先复习初中所学有关共价化合物知识,提问学生:
什么叫做共价化合物?(以共用电子对形成分子的化合物) 如何用电子式表示共价化合物 HCl 分子的形成过程?
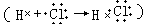
在复习的基础上提出进一步认识共价化合物分子中共用电子对在什么条件下才能形成,以及共用电子对形成的实质等问题,引起学生求知的悬念。 (2)然后从氢分子形成的热化学方程式 H+H→H2+436.4kJ 讲起,引导学生
逻辑分析。
以热化学方程式中所表示的两个氢原子结合成 H2 分子时所放出能量的具体实验数据,论证体系能量降低,表明形成了稳定的 H2 分子,从而得出分子中两个氢原子之间具有强烈的相互作用,即产生了化学键的结论。
接着进一步提问:两个氢原子是怎样形成化学键,结合成氢分子的? 对比讨论:
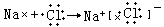 氯化钠的形成,是由于氯原子和钠原子之间发生了电子的得失,钠原子变成了阳离子,氯原子变成了阴离子,阴、阳离子间通过静电引力作用形成化学键(离子键),结合成氯化钠。用电子式表示氯化钠的形成:
氯化钠的形成,是由于氯原子和钠原子之间发生了电子的得失,钠原子变成了阳离子,氯原子变成了阴离子,阴、阳离子间通过静电引力作用形成化学键(离子键),结合成氯化钠。用电子式表示氯化钠的形成:
氢分子的形成则不同。由于两个氢原子核对电子的作用力一样,两个氢原子之间不可能发生电子的得失,亦即它们不可能变成阴、阳离子以形成离子键,而是两个氢原子的电子形成一对共用电子对,由此产生氢原子之间强烈的相互作用——化学键,从而结合成 H2 分子。用电子式表示氢分子的形成:
H· + H→H· H亦可用一根短线表示氢分子中的一对共用电子,因此,
氢分子可表示为 H—H。
再提问:为什么在通常情况下氦原子能稳定地单独存在,而氢原子却不稳定,需要与另一个氢原子形成具有一对共用电子对的氢分子才稳定呢?
对比讨论:
氦原子的 1s 轨道已经有两个电子,达到了全充满的稳定状态,故氦原子稳定。
单个氢原子的 1s 轨道上只有一个未成对的电子,没有达到全充满状态, 故不稳定。当两个各有一个未成对电子的氢原子相互接近,而且其电子又自旋方向相反时,则它们的两个电子配对共用,同在两个原子核周围运动,填充了两个氢原子的 1s 轨道,从而使每个氢原子的 1s 轨道呈全充满状态,每个氢原子就具有了类似氦原子的稳定结构,因此,氢分子稳定。
追问:如果两个氢原子的未成对电子自旋方向相同,互相接近时,能否形成稳定的 H2 分子呢?
对比讨论:
当两个电子自旋方向相反的氢原子互相接近形成化学键结合成氢分子时,实质上是两个氢原子的 1s 电子云有较大部分的重叠,同时放出能量,使
体系能量降低,两核间的电子云密集,对两核产生引力,把两个氢原子结合在一起而形成稳定的氢分子。
如果两个电子自旋方向相同的氢原子互相接近时,则两个氢原子的 1s 电子云在两核间的密度几乎等于零,两原子间不能形成化学键,亦即不能结合成稳定的氢分子。由此可知,并不是任意两个氢原子都能形成化学键而结合成稳定的氢分子的。
概括出定义:原子间通过共用电子对(电子云重叠)所形成的化学键, 叫做共价键。
小结:
形成共价键的条件:
-
两个成键原子必须都有未成对的电子,并且这两个电子自旋方向必须相反。
-
形成共价键时,电子云发生重叠,重叠程度越大,共价键越牢固。形成共价键的实质是:成键的两个原子的电子云发生重叠,同时放出能
量,使体系能量降低,两个核间密集的电子云对两核产生引力,把两个原子结合在一起。
表示共价分子的书写方式:
H H · H H—H
分子式 电子式 结构式
分子式电子式结构式
以上这种从氢分子形成的热化学方程式讲起,把共用电子对、自旋方向相反的电子配对、电子云重叠和成键放出能量体系趋向稳定几个方面统一起来的教法,是从教学实践中总结出来的较好的经验[7]。这种教法有利于突出本节教学重点,突破本节教学难点,发展学生的逻辑思维,使学生对共价键的形成和共价键这一概念获得较深刻的认识。
- 充分应用数据、图形和幻灯,加强教学的直观性。
这部分的教学在加强直观性方面,除前面已讲到论证 H2 分子形成,可应用氢分子形成的热化学方程式中能量数据这一实验事实外,在讲两个氢原子的 1s 电子云重叠时,应指导学生学会利用氢分子形成前后电子云变化情况的图象,观察和理解氢分子形成时电子云重叠的过程。还可采用复合式幻灯片演示 H2 分子形成时共用电子对(电子表示式)和电子云重叠(电子云图象示意)的过程,产生动的图象,使学生对共价键的形成更易理解[8]。
(二)重视课堂讨论、归纳小结和练习
采取课堂讨论、归纳小结和练习这些措施,都是为了加强学生学习的主动性,使学生的思维活动逐步深化,保持理论学习的兴趣和积极性,获得理解的、巩固的理论知识,并培养独立学习的能力。
在重点讲授了氢分子的形成之后,学生已基本懂得了共价键的概念、形成的条件以及用电子式、结构式来表示共价分子的书写方式。这样,对 Cl2、N2、HCl、H2O 共价分子的形成这段教材,就可逐步采取指导学生看书,启发学生讨论和课堂练习等教学方法,让学生用电子式表示这些共价分子的形成,并练习书写 Cl2、N2、HCl、H2O 的电子式和结构式,以达到深化认识和巩固地掌握电子配对法与共价键概念的目的。
接着在指导学生阅读有关部分课文、(H—H 键的键长示意图及某些共价
键的键能表)的基础上,引导学生小结键长、键能的概念和应用,让学生练习查表,应用键长、键能数据判别键的强弱和分子的稳定性。
关于共价键的饱和性和方向性,虽然也是本节教学的重点内容,但因学生已初步掌握了共价键形成的条件、原子核外电子的排布规律和原子的电子层结构以及电子云的伸展方向等知识,所以,只要予以引导,学生就能很自然地得出共价键有饱和性和方向性的结论。因此,可以采取指导学生阅读教材,并以 H2S 分子成键为例,引导学生讨论、归纳、阐明共价键具有饱和性和方向性的理论要点;小结对比共价键和离子键的联系和区别。在讨论共价键具有方向性时,辅以硫原子的 3p 电子的方向性及 H2S 分子成键图象的幻灯片或电子云模型,引导学生小结键角的概念和应用。教师要强调掌握和应用键能、键长、键角这些参数的重要性。
最后讲授配位键,可配合演示氯化铵生成的实验,引出表示生成氯化铵的化学反应的分子方程式和离子方程式。然后,运用电子式表示铵离子的形成过程,分析铵离子(NH
- )中配位键的形成,突出配位键形成的条件
(一个原子有孤对电子,另一个原子有空轨道)。加深学生对配位键的理解。引导学生归纳配位键的概念,小结配位键和共价键的联系和区别,练习书写铵离子的电子式和结构式。
(三)注意掌握深广度
关于“共价键”这节教材的深广度,可以参阅全日制十年制高中化学第一册教学参考书[9]中的说明。
在本节教材中,因限于学生此时的知识水平,讨论共价分子的形成时, 用的是电子配对法,而没有介绍分子轨道法。举例时没有举氧分子的形成, 这是为了避免涉及氧分子中的三电子π键,因为学生尚无理解三电子π键的基础。教材在讨论电子云重叠时,因学生还未具备理解原子轨道重叠的知识基础,就没有提出原子轨道重叠这一概念。在举例讨论共价键的方向性时, 也有意识地避开了杂化轨道概念。这些有关深广度的问题,教学时必须充分体会其精神,掌握好分寸,不要任意扩大教学内容的深广度,以免造成学生学习上“食而不化”的不良后果。
