二、化学计算的教学特点
化学计算的教学特点,主要有下述几个方面:
(一)突出分析化学计算的依据,从狠抓化学涵义着手。
教学中应使学生充分认识到化学计算是为了解决化学上的问题,必须以元素化合物知识、化学基本概念、化学基础理论、化学实验现象和数据为依据。离开了这些依据,是无从进行化学计算的。这也就是化学计算与单纯的数学运算的区别。中学化学计算所用到的数学运算方法大都是比较简单的, 但学生中却常常出现计算上的错误。考查原因,大都是由于学生未弄清化学计算所依据的化学概念、理论、实验事实等。例如,初中三年级的学生在计算水的分子量时,有的错算为 1×2×16×1=32。这是由于对 H2O 的涵义理解不清造成的。如果帮助学生弄清了分子式和分子量的概念,学生自然不难得出水(H2O)的分子量=1×2+16×1=18 的结论。又如有的学生在求物质纯度的计算上出现错误,就有必要帮助他们理解“纯物”和“不纯物”的区别, 必要时还可在课堂上展示实物样品,加强直观教学。
在用例题进行解题示范时,要引导学生懂得并学会解题时着重分析计算的化学涵义,把计算和分析结合起来。在此基础上引导学生从总结计算规律的角度,自己归纳或推导出计算公式。这样,才能使学生真正明确公式的涵义和掌握它的适用范围,并做到灵活运用。也才能防止死记硬背和生搬硬套公式的现象。
对公式的应用,一般说来,在低年级应当严格训练和培养学生运用化学基础知识来分析题意,得出正确的解题思路,少套现成的公式。而在化学计算训练已有一定基础的较高年级,则可逐步适当增加直接应用公式计算的练习,以求简捷、熟练、迅速地进行化学计算。但是,无论何时,都始终不可忽略要在理解的基础上运用公式这一前提。
(二)加强解题方法和步骤的指导
化学计算的目的之一,是使学生“获得化学计算的基本技能”。所以, 应把指导学生掌握化学计算题的解题方法和步骤,作为化学计算教学的一个重点。
化学计算题是化学习题的一种,它的解题方法和步骤与第三章介绍过的完成习题的方法和步骤基本相同。当然也有一些不同于完成一般习题的特点。具体说来如下:
首先应复习有关的化学基础知识。例如,根据分子式进行计算时,必须先复习掌握分子式的意义和正确写法;应用化学方程式进行计算时,一定要复习掌握有关的化学反应的知识和能正确地书写出该化学反应方程式,并了解其涵义;在计算摩尔浓度时,对于溶液浓度、摩尔、以及摩尔浓度的涵义及其计算方法,都须复习了解清楚等等。
其次是准确审题,分析题意。审题的最终目的是要找出已知项和未知(求解)项的内在联系,抓住解题的关键和得出最佳的解题方案。
在准确审题,分析题意,形成合理的解题方案的基础上进行解题。解题格式应当规范化。
最后是检验复核。养成复核的习惯,不仅是为了防止解题过程中可能出现的疏漏,而且也有助于培养学生严谨的学习态度。
下面,着重讨论化学计算题的解题格式规范化问题。解题的格式决不仅仅是个形式,它反映并引导着解题思路。因此,解题格式规范化,有利于培养学生逻辑思维能力。
解题的格式规范化并不是固定化。不同类型的计算题,应当有与之相适应的书写格式。下面举例说明解答化学计算题时可以采取的格式。
[根据分子式求分子量]这类题目,只需先写“解”字,然后正确写出分子式并据以计算,最后写出答案即可。
[例题]计算三氯化磷的分子量。答案即可。解:PCl3 分子量=31+31.5×3
=137.5 答:三氯化磷的分子量为 137.5
[根据化学方程式的计算]一般可按以下格式书写: (1)列出已知条件。
(2)设所求物质的未知量为 x(注明单位)。(3)正确写出并配平有关的化学反应方程式。
- 将与解题有关的物质之间量的关系,写在化学反应方程式中相应的化学式之下。
量的关系的选择(用质量比,或物质的量之比,或气体体积比,或质量和气体体积比关系,或物质的量和气体体积比关系等)和单位的选择都应符合题意要求和方便计算。
- 将已知量和未知量 x
对应写在关系量的下面(注意上下单位一致)。(6)列比例式、计算求出未知量 x。(计算中可不写出单位,但计算结果
要标明单位,并在单位上加括号。) (7)简明地写出答案。
[例题 1]将氯酸钾加热分解制取氧气。现要制取 2g 氧气,问需要多少g 氯酸钾。
解:已知:将氯酸钾加热要制得 2g 氧气。设:需 xg 氯酸钾。
2KCLO3
MnO2
△
2KCL + 3O2
(39+35.5+16×3)×2=245 16×2×3=96 245g 96g
xg 2g
245∶X=96∶2
x = 255×2 = 5.1(g) 96
答:制取 2g 氧气需要 5.1g 氯酸钾。
[例题 2]将 2.5g 纯碳酸钙与盐酸完全反应,生成的二氧化碳在标准状况下体积是多少升?需消耗盐酸几 mol?
解:已知:与盐酸完全反应的纯碳酸钙为 2.5g。
设:生成二氧化碳的体积(标准状况下)为 xL;需消耗盐酸 ymol。CaCO3+2HCl=CaCl2+CO2↑+H2O
40+12+16×3=100
100g 2mol 22.4L
2.5g ymol xL
(1)求 CO2 的体积(标准状况下)。
100∶2.5=22.4∶x
x = 2.5×22 4 = 0.56(L)
100
(2)求盐酸的量。
100∶2.5=2∶y
y = 2.5×2 = 0.05(mol) 100
答:2.5g 纯碳酸钙与盐酸完全反应,生成的二氧化碳体积(标准状况下)为 0.56L,需消耗盐酸 0.05mol。
[有关平衡常数的计算]解题格式一般可用下列形式:积(1)列出已知条件。
-
设所求物质的未知量为 x。
-
正确写出并配平有关的化学反应方程式。(4)写出起始浓度和平衡浓度。
-
应用平衡常数表达式进行计算,求出未知量 x。
-
简明地写出答案。[例题]在密闭容器中,给一氧化碳和水蒸气的混和物加热,在有催化剂存在下发生下列反应:
 CO+H2O
CO2+H2
CO+H2O
CO2+H2
在 500℃时,平衡常数 K=9。若反应开始时,一氧化碳和水蒸气的浓度都是 0.02mol·L-1,试计算在此条件下 CO 的转化率。
解:已知:500℃时,K=9;
起始时[CO]=[H2O]=0.02mol·L-1。设:平衡时有 xmol·L-1CO 已转化。
 则,
CO+H2O H2+CO2
则,
CO+H2O H2+CO2
|
起始浓度 mol·L-1 |
0.02 |
0.02 |
0 |
0 |
|---|---|---|---|---|
|
平衡浓度 mol·L-1 |
0.02-x |
0.02-x |
x |
x |
[H 2 ][CO2 ] X 2
K = [CO][ H O] = (0.02 − x)(0.02 − x) = 9
解之得,x=0.015mol·L-1
故,CO转化率 = 0.015 ×100% = 75% 0.02
答:在 500℃时,CO 转化为 CO2 的转化率是 75%。
有些化学计算题,在解题时单用列式计算的格式,往往不容易让人看懂。在这种场合,辅以必要的文字叙述,会显得更加明了。
[例题]有铁的氯化物 0.5g,与过量的硝酸银反应,生成明 1.13g 氯化银沉淀。问这种氯化物是氯化亚铁还是氯化铁?
解:氯化物与硝酸银反应都能生成氯化银沉淀。
设:此铁的氯化物分子式中含氯原子的个数为 x。
因,氯的化合价为负一,所以铁的化合价数就决定了此氯化物分子中氯原子的个数。
故:该氯化物的分子式为 FeClx,写出 FeClx,与 AgNO3 反应的化学方程式,并根据有关量算出 x 的值,就知道是氯化亚铁还是氯化铁了。
 即:FeClx+xAgNO3
xAgCl↓+Fe(NO3)x
即:FeClx+xAgNO3
xAgCl↓+Fe(NO3)x
(56+35.5×x)g (108+35.5)xg
0.5g 1.13g
(56+35.5x)∶0.5=143.5x∶1.13
∴x = 63.28
31.64
=2
此氯化物的分子式为 FeCl2
答:这种氯化物是氯化亚铁。
此题也可直接写出 FeCl2 或 FeCl3 与硝酸银反应的化学方程式,然后计算出 0.5g 的 FeCl2 或 FeCl3 与硝酸银反应所生成的 AgCl 的量,恰等于 1.13g 者则证明它就是那种化合物。
由上可见,化学计算题的解题格式规范化的实质,是在于完整而简明扼要地反映解题的逻辑思路。化学计算题虽然是多种多样的,但只要引导学生先学会“列已知,设未知,按关系列出算式,计算求解,写答案”这一基本格式,然后再循序渐进地指导学生根据题目类型,灵活运用基本格式并加以演变,就不难使学生掌握“用格式引导思路,以思路决定格式”[2]的精神。
(三)采用多种措施,提高学生解答化学计算题的能力
- 指导学生掌握各类化学计算的特点和解题关键,并在基本类型上多下功夫。
在教学中要有计划地按类型精选范例分析讲解,指导学生系统掌握各类化学计算的特点解题关键及规律,并在基本类型上多下功夫,使学生获得举一反三的能力,并为解综合题打下坚实的基础。
例如,有关溶液的浓缩、稀释或各种浓度的换算等计算的解题关键,在于在正确理解各种溶液浓度的概念的基础上,抓住溶液中“溶质的量不变” 这一特征。
有关溶解度计算的解题关键,则在理解溶解度定义的基础上,熟练运用在一定温度下某物质的饱和溶液存在的下述关系:
溶质的质量(g) = 溶剂的质量(g)
溶解度(g) 100(g)
= 溶液的质量(g)
溶解度(g) + 100(g)
对于两种反应物的量都为已知的计算,其解题关键是首先要判断哪种反应物是“过量”的,然后按“不足量”物质的量去计算生成物的量。关于多步反应的计算,其解题关键是从分析各步化学反应方程式着手,找出有关反应物与生成物之间的相应关系,建立起正确的关系式。
- 提倡一题多解,培养学生的解题技巧。
在化学计算教学中,应当在学生掌握化学计算的一般解题方法的基础
上,进一步运用典型示范的办法,逐步介绍并提倡一题多解。特别是在复习课里更有必要。在示范一题多解时,要注意分析比较多解中的最佳解题方案。要鼓励学生广开思路,练习一题多解并评选最佳方案,教会学生用最合理、最简捷的方法解题。这不仅能激发学生对化学计算的兴趣,培养和提高解题技能和技巧;同时也是发展学生智力,培养他们的灵活性和创造精神的重要途径。
下面举例说明。
[例题]把 100g 铁棒放在硫酸铜溶液里,过一会儿取出,洗净、干燥, 棒的质量增加到 103g,问析出了多少克铜?[3]
解法 1,从分析化学反应中铜的析出量和铁棒增重量的关系出发,用基本比例法求解。
解:已知:100g 铁棒在硫酸铜溶液里发生化学反应后,棒的质量增加到103g。设:有 xgCu 析出。
因,Fe+CuSO4=FeS04+Cu↓ 56 64
从化学反应方程式可知,每有 56g 铁参加反应,就有 64g 铜析出,则棒
增重 64-56=8(g)。
又,据题意,棒增重 103-100=3(g) 则,64∶x=8∶3
x = 64×3 = 24(g)。8
答:有 24g 铜析出。
解法 2,从分析化学反应中铜的析出量和铁的消耗量关系出发,用简化比例法求解。
解 已知:(略) 设:析出铜 xg。
则,据题意,消耗的铁为:
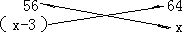
 x-(103-100)=(x-3)(g)
Fe+CuSO4 FeSO4+Cu↓
x-(103-100)=(x-3)(g)
Fe+CuSO4 FeSO4+Cu↓
56x=64(x-3) x=24(g)
答:(略)
解法 3,根据题意分析,在抓准化学反应中铜和铁相关量的基础上联立方程组,用代数法求解。
解:已知:(略)
 设:析出的铜为
xg,消耗的铁为 yg。则,Fe+CuSO4 FeSO4+Cu↓
设:析出的铜为
xg,消耗的铁为 yg。则,Fe+CuSO4 FeSO4+Cu↓
56 64
y x
56x = 64y ①
得联立方程组: x − y = 3 ②
解方程组:
由①得y = 56x 7 ③
把代③入②:
64 = 8 x
7
x - 8 x = 3
8x-7x=24
X=24(克)
答:(略)
解法 4,从分析反应中铁棒增重量出发,利用化学反应中铜和铁的物质的量之比关系求解。
解:已知:(略) 设:析出铜 xmol。
 因,Fe+CuSO4
FeSO4+Cu↓ 56g 64g
因,Fe+CuSO4
FeSO4+Cu↓ 56g 64g
1mol 1mol
依上述化学方程式知,析出铜为 xmol 时,消耗的铁也为 xmol。则,棒的质量应增加到(100-56x+64x)g
根据题意:100-56x+64x=103
解之x = 3 (mol)
8
故,析出铜的质量:64
答:(略)
3
× 8 =
24(g)
解法比较分析:[解 1]、[解 2]都比较清晰简捷,其中[解 2]较[解1]更简捷。[解 3]是代数法,在此题中不如[解 1]、[解 2]、[解 4]简捷。但代数法在解复杂的问题时,有其方便之处。[解 4]也较简捷,但这种解需在掌握摩尔概念之后,才能阍擞谩*
- 通过综合题的训练,提高学生化学计算技能和解题能力。
由于综合题是各类习题的有机结合,它把许多化学基本概念、原理、物质知识(甚至相关学科的有关知识)和各种基本技能联系在一起,涉及到的化学计算问题比较复杂。因此,通过富有启发性的综合题的练习,可以更好地训练学生灵活运用知识,提高学生化学计算技能和解题能力。教师要在抓好学生的化学计算基本类型习题练习和训练他们计算技能基本功的基础上, 有目的、有计划地配合教学进度,适当选择一定数量的综合性题目布置学生练习。在加强综合计算题的解题指导时,首先仍应着重在题意分析和解题思路上。[4]同时,也要进行数学运算方面的指导,特别要使学生注意在化学运算中对所用单位以及单位间的换算不出错误。
[例题]1mol·L-1AlCl3 溶液 75ml 和 2mol·L-1NaOH 溶液 120ml 混和, 可得到 Al(OH)沉淀多少 g:[5]
对这个综合题进行题意分析和解题思路方面的示范指导,可作如下的叙
述。
根据题意可知,本题属于已知两反应物(AlCl3 和 NaOH)的量求生成物
[Al(OH)3 沉淀]的量这一类型。解题时,可按下列步骤:
-
首先根据有关化学反应方程式(AlCl3+3NaOH=Al(OH)3↓+3NaCl)和已知条件,计算判断哪种反应物过量?过量多少?从而得知 NaOH 过量。不足量的反应物即为 AlCl3。
-
根据上述反应中 AlCl3 和 Al(OH)3 之间量的关系,按“不足量”物质AlCl3 的量推算出生成 Al(OH)3 沉淀的量。
-
由于 Al(OH)3 是两性物质,在过量的碱中会被溶解。因此,还应根据Al(OH)3 被 NaOH 溶解的反应方程式[Al(OH)3+NaOH=NaAlO2+2H2O],计算出生成的 Al(OH)2 被过量的 NaOH 重新溶解的那部分的量(这一步计算,学生往往没有考虑到)。
-
最后计算出 Al(OH)2 沉淀的生成量和重新溶解的量之差,即为实际得
到 Al(OH)2 沉淀的量。得到的是 Al(OH)2 物质的量,根据题意要求将其换算为质量。
应向学生指明,为了使运算过程更加简捷,最好在开始运算时,把应用
的单位统一换算成摩尔。解题运算过程如下:
解:已知:2mol·L-1 NaOH 120ml,
1mol·L-1 AlCl 75ml。
则, NaOH的量 = 2× 120
1000
= 0.24(mol);
AlCl3 的量 = 1×
75
1000
= 0.075(mol)
- 判断哪种反应物过量。
因 AlCl3+3NaOH=Al(OH)3↓+3NaCl
物质的量之比 1 ∶3 ∶1
可知 0.075molAlCl3 全部参加反应转变成 Al(OH)3,需要消耗 NaOH 的量为:0.075×3=0.225(mol)
现有 NaOH 0.24mol,故 NaOH 过量:
0.24-0.225=0.015(mol)
- 求用 0.075mol AlCl3 反应所应生成 Al(OH)3 沉淀的量
由以上物质的量之比关系可知,反应消耗AlCl30.075mol,应生成Al(OH)3也是 0.075mol。
- 求被 0.015mol NaOH 溶解的 Al(OH)3 沉淀的量。
因 Al(OH)3+NaOH=NaAlO2+2H2O
物质的量之比 r∶ 1
可知,被 0.015mol NaOH 溶解的 Al(OH)3 沉淀也是 0.015mol。(4)实际得到的 Al(OH)3 沉淀:
0.075mol-0.015mol=0.06mol 78g·mol-1×0.06mol=4.68g
答:可得到 Al(OH)3 沉淀 4.68g。
- 加强讲评,重视正误对比和分析总结。
提高学生化学计算技能和解题能力,决非一日之功。要经常了解、分析、
总结学生课内练习和课外作业的情况,归纳整理出学生在审题、解题思路、解题方法和书写格式等方面的创见和较普遍存在的问题,结合平时的教学或在阶段复习时进行正误对比的讲评。鼓励学生的创造性见解,并针对一些常见性的错误,选择适当的题目加强课内外的反复练习。同时,组织、引导学生自己总结解答化学计算题的经验教训,从而不断提高化学计算技能和解题能力。
