§6-3 元素与化合物教学示例
在前面第五章第一节“备课”中,曾讨论过初中化学中“氧气的性质和用途”的教学,它是元素、化合物的“理论前教材”的教学示例。这里再举一个属于“理论后教材”的有机化合物教学的例子。
例.高中化学教材中“甲烷”的教学。一、地位和作用
“烃”是中学化学教材中无机化学部分结束后有机化学的开始。
有机化学知识不仅有助于人们探索动植物界生命的奥秘,而且是有机化学工业的理论基础。它在农业、医学、能源、材料等科学技术研究领域里都占有极其重要的地位。近几十年来,在科学知识“爆炸性”增加的总趋势下, 据统计,全世界已知的有机化合物有五百多万种,而且现在每年都有许多有机化合物被合成出来,对国民经济的发展和人民生活水平的提高起着重要的作用。因此,在中学普及有机化学基础知识,对于学生今后参加四化建设或继续学习深造都具有重要的意义。有机化学基础知识是中学化学课程的重要组成部分之一。
“烃”是有机化合物的母体,其它千万种有机化合物都可看作是由“烃” 衍变而来的。本章教材运用从个别到一般的方法介绍各类烃的代表物质,如甲烷、乙稀、乙炔和苯等的组成、分子结构、性质、用途和制法,并由之推导出各类烃的通式和通性。对有机化合物的主要特征,如有机化合物较无机化合物种类多,大多结构复杂、难溶于水、是非电解质、熔点低、易燃烧、易分解、易溶于有机溶剂、反应速度较慢、且常伴有副反应等,均有阐述。这为以后学习烃的衍生物奠定了基础。
一般将“烃”这一章教材编排在物质结构、元素周期律和氮族元素之后。讨论烃类物质时,突出了结构与性质的关系,从碳的原子结构特点及其在周期表中的特殊位置看有机化合物中碳原子与其它元素的原子形成化学键的特点,以及碳-碳键的形成;从环键、链键的形成与特点,以及引用键角、键长、键能等数据讨论分子结构及其对物质性质的决定性作用;从分子结构的变化弄清有机化学中重要的反应类型的反应原理,理解各类烃之间以及烃与烃的衍生物之间的相互关系和变化规律。在化学用语上突出了电子式、结构式和结构简式的书写和运用。在化学计算方面,突出了从实验数据的分析计算, 判断物质的组成。在化学实验方面,突出了从实验现象推断物质分子结构的特点。本章教材体现了物质结构理论的指导作用,不仅应用了物质结构知识, 而且还巩固和扩大了物质结构的知识。
甲烷是烃类中最简单的一种代表性物质。研究有机物从甲烷开始,便于在学生已有的知识水平上由浅入深地讨论组成、结构等难点问题,也便于在研究烃的性质时给出学习提纲,循序渐进地逐步展开有机化合物的教学。
二、教学目的
-
在复习碳原子的原子结构和共价键的知识的基础上,掌握甲烷的电子式、结构式的写法,并理解甲烷分子的正四面体的立体结构。
-
掌握甲烷的性质,了解甲烷的实验室制取和收集方法。
-
通过甲烷分子式的推导计算,培养学生推理能力和求气态物质分子式的思路与基本方法。
三、教学重点
甲烷的分子结构和甲烷的性质。四、教学难点
甲烷的分子结构。五、教法讨论
- 本节教材内容包括:烃的涵义;甲烷在自然界里的存在;甲烷分子的组成和结构;甲烷的制法、性质和用途四个部分。可依此次序进行教学。另外,对于杂化轨道理论,用 SP3 杂化说明甲烷分子的正四面体结构和由四个σ键构成的这部分内容,如有条件可适当介绍,以扩大学生的物质结构知识。
“烃”的概念可从上一节内容“组成有机物的元素(除碳外,通常还有氢、氧、氮、硫、卤素等)”引入,突出烃是仅由碳和氢两种元素所组成的一大类有机化合物。并进一步强调“一大类”的涵义,引出这一大类物质中最简单的一种——甲烷。
在指导学生读书的基础上,简介甲烷在自然界的存在。并联系实际指出天然气是以含甲烷为主的矿藏,制取沼气是开发生物能源的重要途径。适当介绍沼气的制取和利用,以激发学生学习甲烷的兴趣,从而集中注意力去学习。
- 突破甲烷分子的组成和结构这个难点,建立空间结构的概念,可采取:
(1)引导学生根据实验测定的甲烷的元素组成和百分组成、气体密度和气
体摩尔体积计算甲烷的分子式。注意总结,使学生领会求气态物质分子式的基本方法、过程和规律,着重培养学生的逻辑推理能力。
(2)引导学生以碳在周期表中的位置,碳原子的结构特点和共价键的知识,分析甲烷的分子结构,并练习用电子式和平面结构式表示甲烷的分子结构。学习运用甲烷的键长、键角的实验数据,描绘甲烷分子正四面体的立体结构示意图。充分运用球棍模型与比例模型展示甲烷分子的空间结构特点。使学生明确、理解甲烷分子中的各键键长相等、各键角相等、四个氢原子的位置是同等的,以建立空间结构的概念。
- 讲好甲烷的实验室制法,要注意: (1)掌握好演示实验成功的关键。
- 所用无水醋酸钠和碱石灰都必须是确保干燥无水的。
无水醋酸钠极易吸收水分,最好在临用前一天制备。如果贮存过久,最好在使用前放置蒸发皿中加热,以除去可能含有的水分,并放在干燥器中保存。
碱石灰的吸湿性很大,如已吸湿,使用前也应研碎烘干。长久保存的碱石灰,如保存不善,其中的氢氧化钠可能吸收空气中的二氧化碳而转化为碳酸钠,则不能用以制取甲烷,因此,最好使用新制的碱石灰。
-
无水醋酸钠与碱石灰应分别研细、混匀,装进试管时要疏松地平铺在底部,并将试管口向下倾斜地夹持在铁架台上。注意仪器装置的气密性。
-
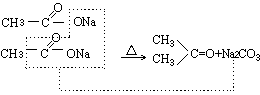
加热时,灯焰应由试管口的一端向后逐渐移动并缓缓加热,以免加热过猛发生生成丙酮的副反应:
-
引导学生对比实验室制甲烷与实验室制氧气的气体发生和收集的仪器装置及操作过程,以加深理解和记忆。
-
讲清反应原理。
- 反应原理中的分子变化可用红粉笔勾出,帮助学生理解和强化记忆。
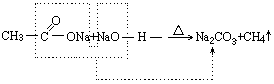
-
要指出分子式不能表示出有机化合物分子结构特点,不便看出反应中分子结构的变化。因此,在学习有机化学中,要熟练地掌握用结构式或结构简式来表示有机化合物和书写化学方程式。正确书写结构式或结构简式,能更好地掌握有机化合物的命名,形象的掌握各类有机化合物的结构特点,推导它们的主要化学性质,也易于看出反应中有机物分子结构的变化,从而掌握变化的规律。
-
要指出有机化学反应往往比较复杂,常有副反应发生,在书写有机化学反应方程式时,无需写出全部反应产物,常用箭头符号(→)代替等号
(=)以表示“生成”。
- 突出讲解甲烷的性质,要注意:
-
展示收集在较大的容器里的甲烷,观察它的状态、颜色、气味等物理性质。
-
通过演示实验,加强理论指导,讲解甲烷的化学性质。
- 根据演示甲烷不能使强氧化剂高锰酸钾的酸性溶液褪色(不起反应) 的实验事实来说明甲烷的化学性质是比较稳定的。再从甲烷分子结构中碳原子和氢原子之间以共价键结合形成稳定的饱和结构来解释甲烷在通常情况下的稳定性。然后推论出甲烷跟强酸、强碱以及其它强氧化剂等一般不起反应。
同时指出甲烷的稳定性是相对的,在一定条件下也能发生取代反应、氧化反应和加热分解的反应。
- 讲授甲烷的取代反应,要突出:
- 演示甲烷分子中的氢原子被氯气分子中的氯原子取代的实验。
演示此实验成功的关键,是要把盛有纯净的甲烷和氯气的混和气体的集气瓶(加盖),放在光亮的地方(注意避免日光直射,否则会引起爆炸)。此外,还应考虑以日光照射难以控制,并受实验时天气的限制,必要时可采用高压汞灯作光源,亦可取得良好效果[2]。
指导学生观察反应前氯气的黄绿色和氯气与甲烷反应后黄绿色逐渐变淡到最后消失,试管内壁附着有油状液滴(几种氯代甲烷的混和物)以及氯化氢的生成(用蘸有浓氨水的玻璃棒检验证明)等现象。
 指出甲烷与氯气取代反应的机理是气相自由基反应。联系
指出甲烷与氯气取代反应的机理是气相自由基反应。联系
Cl—Cl 键能数据,在受光或热的作用下均裂为活泼的 Cl·自由基(带有未配对电子的原子或原子团),指出它与稳定的无机离子的区别。引发形成连锁反应(或叫链反应),可作如下板书,增强形象,以利于理解甲烷与氯气取代反应的机理(自由基反应)。
链的引发 Cl2 2Cl
链的增长 CH4+Cl·→·CH3+HCl
·CH3+Cl2→CH3Cl+Cl· CH3Cl+Cl·→·CH2Cl+HCl
·CH2Cl+Cl2→CH2Cl2+Cl· CH2Cl2+Cl·→·CHCl2+HCl
·CHCl2+Cl2→CHCl3+Cl· CHCl3+Cl2→CCl4+Cl·
·CCl3+Cl2→CCl4+Cl· 链的终止 2Cl·→Cl2
2·CH3→CH3—CH3
Cl·+·CH3→CH3Cl
由自由基反应的过程,就可推知在甲烷与氯气的取代反应中不会有 H2 生成。
- 讲解取代反应的定义“有机物分子里的某些原子或原子团被其它原
子或原子团所代替的反应”时,应推敲其中“有机物分子”、“原子或原子团”、“代替”等关键字词,对比无机化学里的“置换反应”并与之相区别。亦可在课堂上练习这方面的习题。
- 要指出取代反应是后面将要介绍的烷烃的特征反应。iii.讲授甲烷的氧化反应,要突出:
- 演示甲烷在空气里燃烧的实验。
点燃前一定要检验甲烷的纯度,证明已经纯净后才可点燃。
在指导观察实验现象时,根据教材叙述不够明显之处,特别要指明观察纯净甲烷燃烧时火焰的颜色(纯净时完全燃烧的火焰呈淡蓝色;混有丙酮时, 火焰夹带黄色)、光亮程度以及是否有黑烟产生,以便与后面讲乙稀、乙炔的燃烧时作对比。
- 指出燃烧时条件不同,产物不同。例如:完全燃烧时 CH4+2O2→CO2+2H2O
不完全燃烧时 CH4+O2→C+2H2O
- 指出可燃性气体甲烷与氧气(或空气)混和后点燃时的危险性。为了加强安全教育,可补充演示点燃甲烷跟氧气或空气混和物引起爆炸
的实验(注意安全操作),以加深印象。同时理解煤矿井下发生爆炸事故的原因。
 iv.讲授甲烷的分解反应要指出在不同条件下发生不同的反应。为此,可补充讲授在隔绝空气的条件下,快速地将甲烷加热到
1500℃迅速反应,迅速冷却时,甲烷分解产物主要是乙炔和氢气。
iv.讲授甲烷的分解反应要指出在不同条件下发生不同的反应。为此,可补充讲授在隔绝空气的条件下,快速地将甲烷加热到
1500℃迅速反应,迅速冷却时,甲烷分解产物主要是乙炔和氢气。
 2CH4
CH CH+3H2
2CH4
CH CH+3H2
- 应注意联系甲烷的实际用途讨论甲烷的性质。
