判断歧化反应的限度
欲知歧化反应正向是否自发,可以求歧化反应的 K 值,K 值越大,说明反应趋势最大。
[例 1—1]
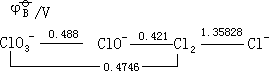
Cl2+2OH-—→ClO-+Cl-+H2O
 E
=1.35828-0.421=0.93728V
E
=1.35828-0.421=0.93728V
nEφ
lg K = 0.059 =
1×0.93728
0.059
= 15.89
K= 7.76×1015
 Cl2+6OH-→ClO—→+5Cl-+3H2O
E =1.35828-0.4746=0.88368V
Cl2+6OH-→ClO—→+5Cl-+3H2O
E =1.35828-0.4746=0.88368V
nEφ
lg K = 0.059 =
K=7.73×1074
5×0.88368
0.059
= 74.89
说明后者歧化反应趋势极大。
当ϕφ − ϕφ
小于零,则发生歧化反应的逆过程。
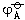 右 左
右 左
BrO3-+5Br-+6H+—→3Br2+3H2O
Eφ = ϕφ
− ϕφ
= 1.478 − 1.0652 = 0.4128V
左 右
nEφ
lg K = 0.059 =
5×0.4128
0.059
= 34.89
K=9.6×1034(歧化反应逆过程的 K 值)
由此可见,在酸性介质中单质溴不发生歧化反应,而是BrO− 与Br − 相
遇,生成溴。
