铁系元素的氧化物、氢氧化物
铁系元素形成的主要氧化物有:
|
FeO(黑色) |
CoO(灰绿色) |
NiO(绿或黑色) |
|---|---|---|
|
Fe2O3(砖红色) |
Co2O3(暗褐色) |
Ni2O3(黑色) |
|
Fe3O4(黑色) FeⅢ[(FeⅡFeⅢ)O4] |
Co3O4(黑色) |
NiO2·xH2O(黑色) |
纯净铁、钴、镍氧化物常用热分解碳酸盐,硝酸盐或草酸制备。如 523K 加热 CoCO3 得到 CoO
 CoCO3
CoO+CO2
CoCO3
CoO+CO2
又如高于 373K 加热 Co(NO3)2,由于硝酸根的氧化作用,分解物为 Co2O3 4Co(NO3)2—→2Co2O3+8NO2+O2
 高
于 398K 加 热 Fe(NO3)3, 得 到 Fe2O3 4Fe(NO3)3 2Fe2O3+12NO2+3O2
高
于 398K 加 热 Fe(NO3)3, 得 到 Fe2O3 4Fe(NO3)3 2Fe2O3+12NO2+3O2
又如于 273K 或 433K 加热 FeC2O4,分别得到 FeO 或 Fe3O4

 FeC2C4
FeO+CO2+CO 3FeC2O4 Fe3O4+2CO2+4CO
FeC2C4
FeO+CO2+CO 3FeC2O4 Fe3O4+2CO2+4CO
由于在较高温度下,空气中氧容易将低氧化态氧化物 MO 氧化为 M2O3,所以无论用它们的硝酸盐、碳酸盐或草酸盐在空气中热分解,制得的氧化物总含有高氧化态的氧化物。在惰气保护下热分解草酸盐 MC2O4,可得到较纯净的低氧化态氧化物 MO,但热分解温度仍不宜过高,否则分解出的 CO2,又将氧化 MO 为 M2O3。
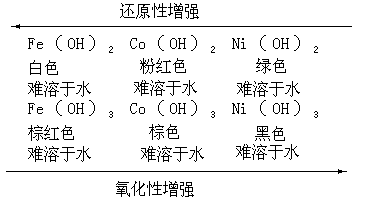
这些氧化物都难溶于水,故其水合物或氢氧化物都应由其相应的可溶盐与碱作用来制取(M=Fe、Co、Ni):
M2++2OH→M(OH)2↓
其中白色的氢氧化亚铁很易被空气氧化成红棕色的氢氧化铁,玫瑰红色的氢氧化钴也可被空气缓慢地氧化成暗棕色的氢氧化高钴(M=Fe、Co):
4M(OH)2+O2+2H2O→4M(OH)3↓而苹果绿色的氢氧化镍不被空气氧化,
欲使其氧化为黑色高价氢氧化物,①必需使用强氧化剂。例如: 2Ni(OH)2+Cl2+2NaOH→2Ni(OH)3↓+2NaCl
铁系元素的氧化物及其水化物基本上都是碱性化合物,其中仅氧化铁及其水合物表现出微弱的酸性。例如氧化铁可与熔融的碳酸钠作用,新沉淀析出的氧化铁可溶于浓的强碱溶液,从而生成亚铁酸盐(FeO
- ):
 Fe2O3+Na2CO3
2NaFeO2+CO2
Fe2O3+Na2CO3
2NaFeO2+CO2
Fe(OH)3+NaOH→NaFeO2+2H2O
由于铁系元素的氧化还原性不同,它们与盐酸作用时产物不同,氢氧化铁和盐酸进行酸碱中和反应, Fe(Ⅲ)不能氧化 Cl-,而后两者(M=Co、Ni)都可氧化 Cl-:
2M(OH)3+6HCl→MCl2+Cl2+6H2O
上述氢氧化物的性质可归纳如下: