氮的固定
氮是所有生命体系化学过程中的一个重要元素,也是粮食作物的决定因素。自然界中氮是取之不尽,用之不竭的。空气中含 80%的氮,但以单质状态的氮却很难变成有用的化合物。因此把空气中的氮转化为可利用的含氮化合物即固氮(Nitrogen fixation)是人们十分关心的课题。
自然界的某些微生物和藻类,通过体内的一种具有特殊催化能力的蛋白质——固氮菌(酶)能将植物不能利用的空气中的氮素转化成可利用的氨态氮,如豆科植物大豆、花生的根瘤菌等。这种生物固氮作用对提高土壤肥力, 保持自然界中氮素循环、节约资金和保护环境有极重要的意义。
长期以来,人们探索用化学方法把空气中的氮转化为氮的化合物,即人工固氮。人工固氮一般有三种:空气燃烧法(电弧法);氧、氮直接合成 NO; 氰氨基盐法,氮与 CaC2 加热至 1073K 形成氰氨化钙(CaCN2 或 CaNCN):
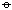 N2+CaC2-→CaCN2+C
氮与氢在高温高压催化剂条件下直接合成氨: N2+3H3→2NH3 △rH =-46kJ·mol-1
N2+CaC2-→CaCN2+C
氮与氢在高温高压催化剂条件下直接合成氨: N2+3H3→2NH3 △rH =-46kJ·mol-1
前两法消耗能量较大,目前广泛使用的氮氢合成氨法,但此法需具备高温高压和催化剂的合成条件。
人工固氮既消耗能量,而且产量也有限,据估计地球上每年生物固氮量约为 2 亿吨,相当于世界氮肥产量的 4—5 倍。可见生物固氮的能力极其强大。人们长期以来一直渴望着能用化学方法模拟固氮菌,实现在常温常压下固定空气中的氮制成氨。从 60 年代起开始了化学模拟生物固氮的研究,经研究证明固氮酶(铁、铁—钼蛋白质)中含有过渡金属与氮分子形成金属—氮分子配合物。这种配合物的形成使 N2 分子活化,易于被还原产生氨。从 1965 年
第一个合成钌的氮分子配合物[Ru(NH3)5N2]X2(X=Cl-、Br-、I-、
BF-、PF- ),到目前为止已合成许多种过渡金属(Ti、Mo、W、Re、
4 6
Fe、Co、Ni、Ru、Rh、Ir、Pt 等)—氮分子配合物。这证明了氮分子与 CO 相似能利用其孤对电子与过渡金属键合,形成过渡金属—氮分子配合物,这些配合物中的 N2 很易被还原为氨,如在可见光激发含有催化剂的 Ru(Ⅱ)—
N2 配合物体系的水溶液,能使 N2 转化为氨。
最近又发现在常温下,用还原剂如 VSO4 或 K2[MoO(CN)4(H2O)]和四氢硼酸盐在特定条件下能将 N2 还原至氨。这说明在常温下氮分子的惰性不是绝对的,在适宜的条件下是具有化学活性的。这些研究目前虽尚处在研究阶段,但为在常温常压下合成氨开辟了广泛的应用前景。
