表 1—9 卤素的含氧酸
|
氧化态 |
|||
|---|---|---|---|
|
+1 |
HOFa |
HOCla HOClOa HOClOaa 2 HOClOb b 3 |
HOBra HOIa |
|
+3 |
HOBrOa |
||
|
+5 |
HOBrOa2 HOIO c 2 |
||
|
+7 |
HOBrOb3 HOIO c 3 |
||
|
( OH ) 5IOc |
|||
|
H4I2O9 |
 在真空中加热到
353K,(HO)5IO 部分失水,生成焦高碘酸: 2H5IO6 H4I2O9+3H2O
在真空中加热到
353K,(HO)5IO 部分失水,生成焦高碘酸: 2H5IO6 H4I2O9+3H2O
 在真空(约
1620Pa)中,焦高碘酸加热到 373K,生成偏高碘酸: H5IO6 HIO4+2H2O
在真空(约
1620Pa)中,焦高碘酸加热到 373K,生成偏高碘酸: H5IO6 HIO4+2H2O
正高碘酸根[IO6]5-其结构如图 1—9 所示:
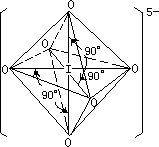
图 1-9 [IO6]5-离子的结构
我们知道,在ClO− 离子中,中心原子氯采取sp3杂化,其点群符号为T ,
4 d
正四面体型。而IO5- 离子,中心原子碘采取sp3d 2杂化,其点群符号为O ,
正八面体型。
d.高溴酸溶液可以浓缩直至 55%(6mol·L-1),甚至在 373K 时不分解。再经浓缩可达 83%,但很不稳定。水合 HBrO4·2H2O 可以结晶出来。
HOF 是无色的固体在 156K 熔化,呈淡黄色液体。在室温时以气体状态存在,与水有高度的活性。HOF 自发分解成氟化氢和氧气。
2HOF→2HF+O2
该反应的半衰期,298K 时为 30 分。它的制备是相当困难,氟与水在低温下才能生成。经研究获知∠HOF 为 97°,而∠HOCl 为 106°。一些化合物中含有 OF 共价键的基团,称为次氟酸盐。如 CF3OF、SF5OF、O3ClOF 和 FSO3OF 等。
