硫化物
已知的硫化物中重要的有 MS2、MS3,其它氧化态的硫化物是很少见的。MoS2 在自然界的辉钼矿存在,在实验室中可用单质直接合成。也可用MoO3
在 H2S 中加热或 MoO3 与 S 粉和 K2CO3 一同加热制得。在高温下它是钼的硫化物中最稳定的,其它硫化物在真空中受热都转变为 MoS2,但强热时,则分解为其组成元素。它是逆磁性的,约在 473K,其晶体有金属导电性。在化学性质上,它十分惰性,仅溶于象王水和煮沸的浓硫酸这样的强氧化性酸中。
MoS2 是层型结构的化合物,在两层位置相同的 S 的密堆积层中,形成许
多三方棱柱体孔隙,钼原子处在由六个硫原子形成的三方棱柱配位体空隙中,这种三棱柱配位体数为钼原子数的一倍,所以钼原子仅占据其中的一半, 由于层型分子堆积的不同,有多种型式,通常的六方 MoS2 的结构为沿 C 轴按AbABaB⋯⋯方式堆积重复的周期是两个层型分子,它的结构示于图 9—7 中。由于层间的结合力弱,层间分子在受到外力时易滑动。有类似石墨的润滑性。经测定表明:如在汽车底盘的润滑油中加 3%MoS2,可使理想行车的距离从1500 千米提高到 6000 千米,它在加压或高速旋转情况下摩擦力反而减小, 故是一种高效固体润滑剂。
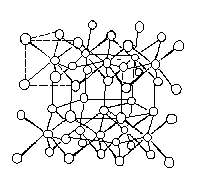
图 9-7 六方 MoS2 的结构
MoS3 是以 H2S 通于钼酸盐微酸性溶液中得棕色的水合硫化物后,经脱水得到:
(NH4)2MoO4+3H2S+2HCl—→MoS3+2NH4Cl+4H2O
这种水合硫化物沉淀,溶于过量硫化碱溶液,生成硫代钼酸盐。
WS3 不能用上述制 MoS3 的方法得到,而在钨酸钠中通 H2S,首先生成硫代钨酸盐(Na2WS4),它在酸性溶液中分解生成亮棕色 Ws3 沉淀。
Na2WO4+4H2S—→Na2WS4+4H2O Na2WS4+2HCl—→WS3+H2S+2NaCl
