三、为什么温度改变颜色会改变?
温度是影响颜色的重要因素。由于温度改变使物质颜色变化的现象称为热至变色。热致变色的原因一般有以下两种。
- 温度使物质的结构发生变化:在过渡金属配合物中,由于温度改变使其结构发生变化致使 d—d 跃迁吸收带改变,与之相应物质的颜色也发生变
化,例如 Ni(Ⅱ)配合物(NRxH4-x)2NiCl4(x=1、2 和 3)有可逆的热致变色,低温时黄棕或绿色,高温时为蓝色,这是由于温度升高,其几何配位发生显著变化,由原来的八面体配位变为四面体配位。这在 Ni(Ⅱ)配合物中是较普遍的。
有些卤配合物,卤化物由于晶型转变引起颜色变化,如常温下 Ag2HgI4
为黄色,50.7℃转为桔红色,Cu2HgI4 常温下红色,70℃转为深褐色。这是因为它们都是由室温下的四方晶系转变为立方晶系所致,SbI3、InCl、HgI2 、TlI、NbCl5 等都有类似的现象。
- 温度升高晶体产生晶格缺陷:ZnO 室温呈白色,加热则变为黄色,冷却又复原,CdO 室温黄色,加热最终为黑色,冷却又复原。这是由晶格缺陷
(金属过量缺陷)所造成,例如 CdO 加热时有易失去氧的特性,得到黑色组成为 Cd1+rO 的固体。这时有相当数目(nr)的阳离子的位置上没有阴离子, 而被电子代替(图 3),在这些空洞中的电子可被激发,激发能在可见光范围内,成为发色中心。ZnO 基本上与 CdO 相似,所不同的只是过量金属阳离子占据晶格的空隙位置,另一空隙由电子占据,保持电中性(图 4)。许多金属氧化物都有类似的热致变色,如 Sb2O3,Sb2O5、SnO2 等。
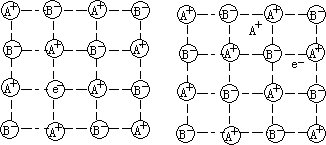
图 3 缺乏阴离子的金属过量缺陷 图 4 空隙阳离子的金属过量缺陷
热致变色的物质是一类非常有用的热色材料,广泛用于检测温度,作热致变色温度指示器。最近日本研制的 BiVO4 和 CaWO4 型的钼酸盐(钨酸盐)组成的固溶体及组成为 PbxSr1-xCrO4(0<X<1)固溶体是可逆热致变色温度指示器的理想材料。此外,还可用作温度传感器,热敏元件等。
(黄佩丽)
上一篇:二、颜色与立体化学环境有关吗?
下一篇:第八章 第一过渡系列元素
