硼的氢化物
硼和氢不能直接化合,但能通过间接的方法得到一系列的共价型硼氢化物,这类氢化物和碳氢化物中的烷烃相似,故称之为硼烷。目前已知有二十多种硼烷,这二十多种硼烷可分属于 BnHn+4 和 BnHn+6 两类,前者较稳定,后者稳定性较差。
硼烷的结构曾在化学家中引起争论,目前已基本解决,在乙硼烷
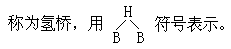 (diborane,B2H6)的六个氢原子中,端点有四个氢原子分别和两个硼原子以正常的
B—H 键结合,并且两个 BH2
处于同一平面。而另两个氢原子分别在这一平面上下,都单独与两个硼原子靠两个电子
B—H—B
成键,这种键被称为三中心两电子键,这种键又可看成是氢原子连接着两个硼原子,也
(diborane,B2H6)的六个氢原子中,端点有四个氢原子分别和两个硼原子以正常的
B—H 键结合,并且两个 BH2
处于同一平面。而另两个氢原子分别在这一平面上下,都单独与两个硼原子靠两个电子
B—H—B
成键,这种键被称为三中心两电子键,这种键又可看成是氢原子连接着两个硼原子,也
 形成乙硼烷这样分子结构的原因是由于硼原子的缺电子性质。硼原子的最外电子层是
2s22p1,当它成键时激发为
2s12p2,并进行 sp3 杂化,形成了四个
sp3 杂化轨道,每个硼原子各以两个 sp3
轨道同两个氢原子的 1s 轨道结合,形成两个 B—Hσ键。在两个 BH3 团中,B
仍然含有一个电子和两个 sp3 轨道(一个轨道上无电子)。这两个
sp3 轨道所在的平面垂直于两个 BH3
所在的平面。因此,当剩下的两个氢原子中的一个氢原子的 1s
轨道和这两个硼原子的各一个 sp3 轨道(只有一个 sp3
杂化轨道上有一个电子)相重叠,就形成
形成乙硼烷这样分子结构的原因是由于硼原子的缺电子性质。硼原子的最外电子层是
2s22p1,当它成键时激发为
2s12p2,并进行 sp3 杂化,形成了四个
sp3 杂化轨道,每个硼原子各以两个 sp3
轨道同两个氢原子的 1s 轨道结合,形成两个 B—Hσ键。在两个 BH3 团中,B
仍然含有一个电子和两个 sp3 轨道(一个轨道上无电子)。这两个
sp3 轨道所在的平面垂直于两个 BH3
所在的平面。因此,当剩下的两个氢原子中的一个氢原子的 1s
轨道和这两个硼原子的各一个 sp3 轨道(只有一个 sp3
杂化轨道上有一个电子)相重叠,就形成
可表示为(3c—2e)键。这是一种离域共价键,另一个三中心两电子键也是这样形成的。图 4—14 为乙硼烷的结构。
简单的硼烷都是无色的,具有难闻气味的气体或液体。硼烷中除了 B9H15 及 B10H14 以外多数硼烷在空气中自燃。硼烷燃烧时,火焰温度很高,比一般碳氢化合物所放出的能量大得多。
B2H6+3O2—→B2O3+3H2O
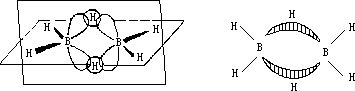
图 4-14 B2H6 分子的结构示意图
△rH=-2166kJ·mol-1
过去曾设想把它们用作火箭或导弹的高能燃料。但后来由于所有硼烷都有很高的毒性、贮存条件苛刻,不得不放弃了这种设想。硼烷水解也放出大量的热,产物是 H3BO3 和 H2,例如:
B2H6+6H2O—→2H3BO3↓+6H2↑
 ΔrH
=-509.2kJ·mol-1
ΔrH
=-509.2kJ·mol-1
此外,乙硼烷还很容易与氨作用,生成二氨乙硼烷。B2H6+2NH3—→B2H6(NH3)2
乙硼烷与 LiH 反应,得到一种比 B2H6 的还原性更强的还原剂硼氢化锂, 其反应如下:
B2H6+2LiH—→2LiBH4
过量的 NaH 与 BF3 反应,可得到白色的晶体 NaBH4,它能溶于水成乙醇,无毒,化学性质稳定。
4NaH+BF3—→NaBH4+3NaF
