金属元素的配位反应
金属离子是路易斯酸能与路易斯碱反应生成配合物。配合物的形成与金属离子的电子构型有关,一般 s 区金属离子除与少数螫合剂形成的配合物外,很少形成稳定的配合物。其它许多金属离子都能形成稳定的配合物,尤以 d 区 ds 区的金属离子的配位能力较强,形成众多的配合物,现将常见金属元素的配离子列于表 11—5。(见上页)
11.4.4. 金属元素的氧化还原反应
 许多金属元素有可变氧化态,故氧化还原反应是它们的重要特征。同一元素不同氧比态化合物,有的用作氧化剂,有的用作还原剂,有的既可作氧化剂,也可作还原剂。它们的标准电极电势值见表
11—2,一般认为(在酸性介质中)ϕ 为 0.5~0.7V 是氧化剂,还原剂的分界值,ϕ
>0.5~0.7V 的电对,通常其氧化型被用作氧化剂,ϕ <0.5~0.7V
的电对,通常其还原型被用作还原剂。金属元素的氧化还原反应很多,除简单的氧化还原反应外,
许多反应是与溶液 pH
值,沉淀剂,络合剂有关的复杂反应,现将反应及反应的一般规律总结如下:
许多金属元素有可变氧化态,故氧化还原反应是它们的重要特征。同一元素不同氧比态化合物,有的用作氧化剂,有的用作还原剂,有的既可作氧化剂,也可作还原剂。它们的标准电极电势值见表
11—2,一般认为(在酸性介质中)ϕ 为 0.5~0.7V 是氧化剂,还原剂的分界值,ϕ
>0.5~0.7V 的电对,通常其氧化型被用作氧化剂,ϕ <0.5~0.7V
的电对,通常其还原型被用作还原剂。金属元素的氧化还原反应很多,除简单的氧化还原反应外,
许多反应是与溶液 pH
值,沉淀剂,络合剂有关的复杂反应,现将反应及反应的一般规律总结如下:
 11.
4. 4.1 金属单质 金 属 离 子 +ne-
M0→Mn+:活泼金属与水、酸、碱、氧化剂反应2Na+2H2O→2NaOH+H2
11.
4. 4.1 金属单质 金 属 离 子 +ne-
M0→Mn+:活泼金属与水、酸、碱、氧化剂反应2Na+2H2O→2NaOH+H2
Zn+2HCl→ZnCl2+H2 2Al+2NaOH+2H2O→2Na〔Al(OH)4〕+3H2 ZN+Cu2+→Zn2++Cu Mn+→M0:金属离子的氧化性2Hg2++Sn2+→2Hg+2Sn4+
2Bi3+ +3Sn(OH) − + 9OH - → 2Bi↓ + 3Sn(OH) 2-
3 6
-
 4.4.2
高氧化态离子+ne- 低氧化态离子
4.4.2
高氧化态离子+ne- 低氧化态离子- 简单金属离子的反应
2Fe3++2I-→2Fe2++I2 Sn2++2Ce4+→Sn4++2Ce3+
- 与 pH 有关的反应
高氧化态金属离子大多以含氧酸根,羟基酸根,氢氧化物,氧化物形式存在,它们的氧化还原反应,高低氧化态间的转化强烈受介质的影响。一般它们作为氧化剂参与反应需要酸性介质。因为酸性介质中它们的氧化性增强
 (由
(由
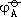 可知),另外,从动力学上看,在酸性介质中,含氧酸氧化反应速度加快。而在碱性介质中低氧化态离子的还原性增强(由
可知),另外,从动力学上看,在酸性介质中,含氧酸氧化反应速度加快。而在碱性介质中低氧化态离子的还原性增强(由
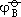 可知)。例如Cr(Ⅵ)与
Gr(Ⅲ)的转化:
可知)。例如Cr(Ⅵ)与
Gr(Ⅲ)的转化:
2Cr(OH) − + 3HO - →2CrO 2- + 5H O+OH -
4 2 4 2
Cr O 2-+3H O +8H+ →2Cr3+ +7H O+3O
2 7 2 2 2 2
这种情况在其它金属元素中也存在:
OH −
O2
浓HCl 2+
Mn2 + → Mn(OH) 2 —→ MnO2 → Mn
( OH− )
2 + OH −
O2 H + +I− 2+
Fe → Fe(OH) 2 —→ Fe(OH) 3 → Fe
( OH − )
Co + OH− → Co OH
NaClo
Co OH
- 浓HCl→ Co2+
2 ( ) 2 —→ ( ) 3 ( OH) −
Ni 2+ OH− → Ni OH
NaClo
Ni OH
- 浓HCl→ Ni2 +
( ) 2 —→ ( ) 3
( OH) −
Pb2+ OH− → Pb(OH
NaClo
- PbO
- 浓HCl→ Pb2 +
Bi OH
) 3 —→
(OH ) −
- NaClo
→ Bi(OH) 3 —→ NaBiO
( OH )−
2
Mn2 +
—→ Bi 3+ 3 ( H+ )
由此,我们可以得出金属元素高低氧化态转化的一般规律:
低氧化态 碱性介质+氧化剂→ 高氧化态 酸性介质+还原剂→ 低氧化态
这个规律同样也适用于熔融体系,例如,由铬铁矿制铬酸钠,由软锰矿制锰酸钾,由三氧化二铁制铁酸钾等。
4Fe(CrO2)2+7O2+8Na2CO3→2Fe2O3+8Na2CrO4+8CO2↑
2MnO2+O2+4KOH→2K2MnO4+2H2O Fe2O3+3KNO3+4KOH→2K2FeO4+3KNO2+2H2O
 11.4.4.3.
中间氧化态 较低氧化态(包括单质)+较高氧化态
11.4.4.3.
中间氧化态 较低氧化态(包括单质)+较高氧化态

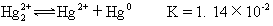 此类反应实际上是歧化与反歧化的反应,常见的有以下几种金属元素:
2Cu+(aq) Cu2+(aq)+Cu0 K=1.4 ×
106
此类反应实际上是歧化与反歧化的反应,常见的有以下几种金属元素:
2Cu+(aq) Cu2+(aq)+Cu0 K=1.4 ×
106
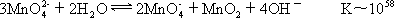
2Mn3++2H2O Mn2++MnO2+4H+ K~109
 由上可见,这三种金属元素中MnO2-、Mn3+
最不稳定,歧化趋势
由上可见,这三种金属元素中MnO2-、Mn3+
最不稳定,歧化趋势
很大,故在一般水溶液中不能存在。Hg2+ 的歧化趋势最小,而反歧化反应即Hg2+ 与Hg0生成Hg2+ 的反应容易进行。Cu+ 在水溶液中也是易歧
化的。
