-
- 3 二氧化氮与四氧化二氮 ( Nitrogen Dioxide and Dinitrogentetroxide) ==========================================================================
NO2 的分子结构,经测定 N—O 键长 119.7pm,O—N—O 键角为 134.3°, 是角形分子,(图 3—8)。N 以 sp2 杂化轨
道与两个O原子形成2个σ键和一个π 3键。
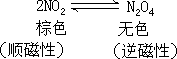 NO2
是奇电子分子,易聚合成无色 N2O4。NO2 和 N2O4
两者处于依赖于温度的平衡中。在固态时都是 N2O4,液态时发生
NO2
是奇电子分子,易聚合成无色 N2O4。NO2 和 N2O4
两者处于依赖于温度的平衡中。在固态时都是 N2O4,液态时发生
部分离解,含 0.7%NO2,气态时是 NO2 和 N2O4 混合物。N2O4 离解能较小,为57kJ·mol-1,在 413K 完全离解为 NO2。这是由于 NO2 有一个未成对电子,这
个未成对电子在很大的程度上是属于 N 原子,因此在形成双聚体时,最稳定的结构可能是 O2N—NO2。N—N 键相当长,为 175pm,这说明这个键很弱,N2O4 的解离能很小就反映出这个键的特征。
这种 NO2 和 N2O4 的混合物,可以由加热硝酸盐、NO 的氧化、硝酸或硝酸
盐用金属或其它还原剂还原等方法来制备。
NO2 和水反应生成 HNO3 和 HNO2,这是歧化反应
2NO2+H2O→HNO3+HNO2
在 423K 时 NO2 开始发生分解
873K 时反应进行得非常完全。
2NO2→2NO+O2
 NO2
和 N2O4 气体混合物的反应活性很大,碳、硫、磷等在其中容易起火,
和许多有机物的蒸气在一起,就成为爆炸性的混合物,并能迅速腐蚀金属。在水溶液中,它们是相当强的氧化剂,其强度与溴相当:
NO2
和 N2O4 气体混合物的反应活性很大,碳、硫、磷等在其中容易起火,
和许多有机物的蒸气在一起,就成为爆炸性的混合物,并能迅速腐蚀金属。在水溶液中,它们是相当强的氧化剂,其强度与溴相当:
 N2O4+2H++2e-
2HNO2 φ =1.07V
N2O4+2H++2e-
2HNO2 φ =1.07V
液态 N2O4 可用作火箭推进剂的氧化剂和制造爆炸药物。液态 N2O4 在无水硝酸中按下式离解:
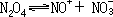
它是良好的非水溶剂,用于制无水硝酸盐(如 Cu(NO3)2)及硝酸根配合物, 还用于制有机硝基化合物等。
NO2 有一个未成对电子,很易失去一个电子形成 NO+2 硝酰离子(Nitryl)。
-
氮的含氧酸及其盐
- 硝酸(Nitricacid)及其盐
