1.1.3.4 单质氟的分离技术·纯化学合成氟
氟单质的分离成功,揭开了笼罩在氟元素的神奇面纱。自然界最活泼的非金属元素终于被征服了。化学家突破了无机化学中最大难题之一。在十九世纪初,自安培(Ampere)断定氢氟酸中含有一种新的未知元素后,许许多多著名科学家致力于氟的研究,但他们并没有取得成功。法国青年化学家摩瓦桑在他的导师弗累密(E·Fremy)的指导下,于 1884 年前赴后继、百折不挠地对氟进行研究。经过多次实验,他突破了两方面的难点。首先是关于原料问题。他思考着:液态氟化氢导电性差,但氢氟酸的水溶液一旦电解,则释放出氧气来。过后他又用三氟化砷、三氟化磷为原料,当通电后毒烟弥漫, 且不见氟的踪迹。最终他摸索出二份无水氟化氢与一份氟化钾的混合物,在
345K 有良好的导电性;第二是关于材料问题。先采用铂做电解槽,但铂与氟生成 PtF4,后改成石墨电解槽,但石墨未经压实,与氟生成 CF4。最终是用铱合金作电解槽,以压实了的石墨作阳极、钢(或蒙及尔合金)①作阴极在373K 左右进行电解低温熔盐的方法。得到了黄色的氟气。这样,于 1886 年 6
月 26 日化学家多年来梦寐以求的理想终于实现了。单质氟分离技术获得成功。其反应方程式如下所示:
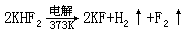
阳极 2F--2e-→F2↑ 阴极 2H++2e-→H2↑
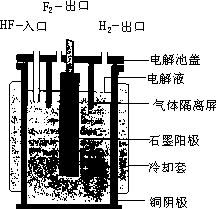
必须提醒的是:氢气的出口与氟的出口一定要隔离。否则会发生爆炸。详见图 1—3。那么,时至今天,是否无法用纯化学法合成氟。回答是否定的。爱德瓦尔德(A·J·Edwards)等人用下列反应,第一次用化学合成法制得了氟。
K2 MnF6 + 2SbF5 —→
1
2KSbF6 + MnF3 + 2 F2
 此反应是利用较强的路易斯酸—SbF5
,从稳定的配离子中置换较弱的路易斯酸—MnF4。然而,MnF4
不稳定,分解释放氟和 MnF3。
此反应是利用较强的路易斯酸—SbF5
,从稳定的配离子中置换较弱的路易斯酸—MnF4。然而,MnF4
不稳定,分解释放氟和 MnF3。
图 1-3 电解制氟的装置
① 镍一铜及少量的铁合金
