非金属卤化物的水解
非金属卤化物一般而言,其水解产物可以生成一种含氧酸和一种氢卤酸,或一种碱和一种酸。譬如:
PCl3+3H2O→H3PO3+3HCl
这是因为磷的电负性小为 2.06,氯的电负性大为 2.83。P3+显δ+,把持水分子中的 OH-,生成 H3PO3,而 Cl-显δ-,把持水分子中的 H+,生成 HCl。
δ+ δ-
P3+ 3Cl-
+ +
3OH- 3H+
H3PO3 3HCl
 NCl3
能发生水解,其水解产物最终是 NH3 和 HOCl,这又如何解释呢?
NCl3
能发生水解,其水解产物最终是 NH3 和 HOCl,这又如何解释呢?
由于中心原子 N 已达到最大共价数,但仍有多余的孤电子对,这时水解反应的发生是通过把电子对给予水分子的质子。这类卤化物水解产生 HOCl 而不是 HCl。Cl2O 水解也一样。

那么为什么 CCl4 不水解,而 SiCl4 能发生水解?又为什么 SF6 不水解而 SF4 能水解?IF7 能发生水解吗?其产物是什么?CCl4,SF6,还有 NF3,不发生水解,阻止水解的因素不是热力学因素而是动力学因素。其实 CCl4,SiCl4 从
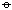
 热力学的基础的计算表明,这两个反应都将进行到接近完全。SiCl4(1)+2H2O(1)→SiO2(s)+4HCl(aq)
△rG =-282kJ·mol-1 CCl4(1)+2H2O(1)→CO2(g)+4HCl(aq) △rG =-377kJ·mol-1
热力学的基础的计算表明,这两个反应都将进行到接近完全。SiCl4(1)+2H2O(1)→SiO2(s)+4HCl(aq)
△rG =-282kJ·mol-1 CCl4(1)+2H2O(1)→CO2(g)+4HCl(aq) △rG =-377kJ·mol-1
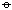 似乎
CCl4 水解将会更彻底。但实际上,从动力学的观点来看 CCl4
的水解是禁止的。因为硅处于第三周期,在 SiCl4
中尽管它的化合价已饱和了,但它的最高配位数可达到 6,这是由于硅原子有空的
3d 轨道,然而碳原子属于第二周期没有 3d 轨道。SF6 象 CCl4
一样,它的反应△G 值是惊人的,但不发生水解。
似乎
CCl4 水解将会更彻底。但实际上,从动力学的观点来看 CCl4
的水解是禁止的。因为硅处于第三周期,在 SiCl4
中尽管它的化合价已饱和了,但它的最高配位数可达到 6,这是由于硅原子有空的
3d 轨道,然而碳原子属于第二周期没有 3d 轨道。SF6 象 CCl4
一样,它的反应△G 值是惊人的,但不发生水解。
SF6(g)+4H2O(1)→H2SO4(aq)+6HF(g)
 △rG
=-423kJ·mol-1
△rG
=-423kJ·mol-1
这是由于在 SF6 中,硫的化合价和配位数都已满足,故 SF6 不发生水解,SF4 能发生水解。
IF7 能发生水解,其水解产物为:
IF + H O 室温→ IOF + 2HF
- 多卤化物(Polyhalide)
