-
非金属元素单质的性质、键型、对角线规则
- 位置
非金属元素位于p区,连同氢总共为22 1
5
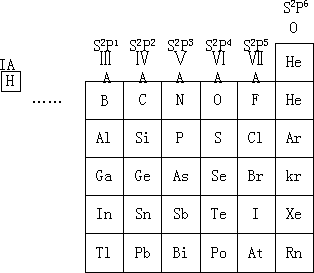 图
5—1
图
5—1
图 5-1 非金属元素在周期表中的位置
氢在周期表中可以归在第ⅠA(1)族,或者ⅦA(17)族,也有人建议把它放在碳的上方,因为氢与电负性大的非金属元素化合呈电正性如 HX,然而它与活泼金属锂、钠反应呈-1 价的离子如 LiH。
在 22 种非金属元素中,人们常常将 B、Si、Ge、As、Sb、Se、Te 和 Po 称为准金属,At 为人工合成元素。锗(Ge)曾是主要的半导体材料,纯锗是不良的导体,当掺入控制量的高纯砷、锑等作为杂质,可成为依靠电子传递而导电的 N 型锗晶体,如果掺入控制量的高纯硼、铝、镓、铟等作为杂质, 可成为依靠空穴移动而导电的 p 型锗晶体。尽管本世纪 60 年代硅半导体开始取代锗半导体而居主要地位,但在某些性能方面,锗仍比硅优越。因此锗半导体元件当前仍有一定的用途。有机锗被誉为 21 世纪人类健康的保护神,有机锗进入人体后把血管壁上多余的蛋白质一道带出体外,故有血液的“清道夫”之称。有机锗可以供给人以充足的氧气,增加血氧,改善微循环,所以有“制氧机”之称。天然有机锗多般存在于灵芝、人参、枸杞子中,人工合成的有机锗-132,经临床证明,其生理活性明显,无毒、无副作用,具有抗睡病、抗炎、免疫调节、抗病毒、镇痛、延缓衰老等作用。
元素周期表中的零族元素称为稀有气体,它包括氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和氡(Rn)。氡为放射性元素。稀有气体原子价层电子构型为 ns2np6(除 He 外),具有稳定的 8 电子构型。它们以单原子的形式存在,原子间作用力很小,因而熔点、沸点都很低,且随核电荷数的减小而递降。在一般条件下,它们的化学性质很不活泼,长期以来一直被称为“惰性气体”。自 1962 年加拿大化学家巴利特合成了第一个稀有气体化合物 Xe[PtF6]以后,才开始了对稀有气体化学活性的研究,证实稀有气体并
不绝对惰性,并从研究中得知,它们的化学性质从上到下逐渐增强。自前已知仅从氪开始具有实际的化学活性,已制出氪氟化物和氪氢化合物。氙的化学活性明显增大,能与氟、氧等形成较稳定的化合物。氡的化合物已制出了氟化氡。
