非金属含氧酸结构简介
迄今为止。国内外教材描述非金属含氧酸的电子结构在理论上,日趋完善。本节只作一个简短的回顾。我们着重介绍是 pπ—dπ键。
- 路易斯结构式
现行教材中表示非金属含氧酸的电子结构,源于路易斯(Lewis)的电子结构。以“∶”表示电子对键。H2SO4 的路易斯结构式:

- 赛奇维克结构式
英国牛津大学化学系教授赛奇维克(N. V. Sidgwick)在这方面又有了重要发展。他指出:在原子间构成化学键时,共享电子对可以由同一原子单
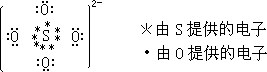 方面提供。称之为“配价”。用“—→”表示方向性的键。例如SO2-。
方面提供。称之为“配价”。用“—→”表示方向性的键。例如SO2-。
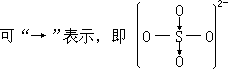
赛奇维克的配价键可以圆满地解释SO2-、ClO - 等。
4 4
- πd 键
在SO2- 中,这是因为硫原子有3d轨道,于是硫原子与氧原子之形成
πd 键,表示如下:
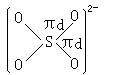
4 pπ—dπ键
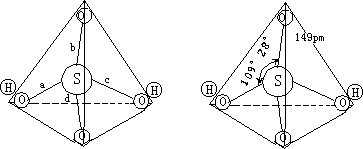 根据实验所测SO2-
是正四面体结构,硫酸为四面体结构见图2—11。
根据实验所测SO2-
是正四面体结构,硫酸为四面体结构见图2—11。
- 硫酸的结构 b.硫酸根的结构图 2-11 硫酸和硫酸根的结构
a—155pm ∠ab=116° b—142pm ∠ac=104° c—152pmp ∠ad=112° d—143pm ∠bc=98°
∠bd=117°
∠cd=109°
在SO2- 中,S—O之间的键长为149pm,比理论计算共价单键169pm要
短些,这说明 S—O 之间绝对不是简单的σ键。
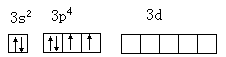
硫原子的 3d 轨道是空的,它与 3s·3p 轨道能量极为相似,在一定的条件下可参与成键。
硫原子基态电子构型
氧原子可以把两个成单电子以相反自旋归并让出一个 2px 轨道,以接受外来配位电子而成键。
氧原子的激发态
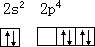
在SO2- 中,中心硫原子采取,sp3杂化(所以为正四面体空间构
 型)。与氧原子的
px 轨道形成σ键配键,尚有 2 个填满电子的 Py 和 Pz 轨道垂直于 S—O
键轴(见图 2—12)
型)。与氧原子的
px 轨道形成σ键配键,尚有 2 个填满电子的 Py 和 Pz 轨道垂直于 S—O
键轴(见图 2—12)
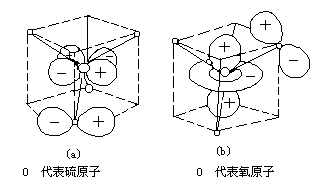
图2 − 12 SO2− 离子中的pπ − dπ配键
此外,氧原子的2p y 轨道上有一对电子与中心硫原子的空的3d x2 - y2 轨
道,两者因对称性相匹配,可以重叠而形成 pπ—dπ配键。同样,氧原子的2Pz 轨道上的一对电子与中心硫原子的空的 3dz2 轨道形成 pπ—dπ配键。这就是说,从中心原子到氧的σ配键和由氧原子到中心原子的 pπ—dπ配键, 而这种 pπ—dπ键比正常的单键略短。
第四、五周期各非金属元素与第三周期情况相似,由于 5d 和 5p,4d 和4p 之间轨道能量差比 3d 和 3p 的能量差更小,所以更趋于形成 pπ—dπ键, 现将结构数据附在表 2—7。
