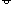 表 6—10 卤化铝的性质
表 6—10 卤化铝的性质
|
Alf3 |
Alcl3 |
AlBr3 |
AlI3 |
|
|---|---|---|---|---|
|
常温下状态 熔 点 /K 升华温度/K △ fH ( kJ · mol-1 ) 键型 |
白色晶体 |
白色晶体 |
白色晶体 |
棕色片状晶体(含 |
|
微量 I2 ) |
||||
|
1564 |
463 |
370.6 |
||
|
1545 |
453 |
529 |
464 |
|
|
654 |
||||
|
-1301 ( s ) |
-695.4 ( s ) |
-527.2 |
-309.6 |
|
|
离子( s ) |
||||
|
离子 |
共价( g 、 l ) |
共价 |
共价 |
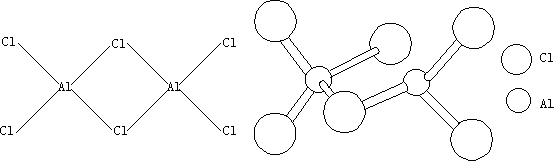
图 6-4 Al2Cl6 的分子结构
中间两个氯桥原子中的每一个氯原子上的一孤电子对进入铝原子的空轨道,
① β—Al2O3 经 X 射线衍射证实为 NaAl11O17,实际上有两类:Na2O·(5~6)Al2O3、Na2O·(11~12) Al2O
以达到 8 电子 Ar 原子稳定结构,可写作 Al—Cl—Al 桥键(氯桥键),为正常的二电子配位键。
二聚分子 Al2Cl6(Al2Br6)高温下解离为 AlCl3(AlBr3)。AlCl3 分子
是平面三角形。溶于水立即解离为Al(H O) 3+ 和Cl - 离子并
强烈水解。
无水 AlCl3 是缺电子体,是典型的 Lewis 酸;可以和 Lewis 碱加合,如AlCl3·NH3。它是有机合成重要的催化剂。
AlCl3 可由铝和氯直接合成,或用氧化物制备:

 2Al+3Cl2
2AlCl3 Al2O3+3C+3Cl2 2AlCl3+3CO
2Al+3Cl2
2AlCl3 Al2O3+3C+3Cl2 2AlCl3+3CO
