硼原子为缺电子原子
由于成键轨道多于电子数,称为缺电子原子,表现为
|
价电子数 |
轨道数 |
形成 8 电子稳定结构 |
|---|---|---|
|
B 3 |
4 |
缺一对电子 |
- 单质硼有十六种同素异形体,由于 B—B 间缺电子,12 个硼原子可组成二十面体,它是各种各样硼化合物的结构基础。单质硼可以多种形式成键, 形成了多种同素异形体,在 p 区各元素中,其复杂性仅次于硫,已知有十六种以上的硼的同素异形体。它们的晶体结构都很复杂,其中最普遍的一种是α-菱形硼,其基本结构单元为正二十面体的对称几何构型。如图 4—13 每个面近似一个等边三角形,20 个面交成十二个角顶,每个角顶为一个硼原子所占据然后由 B12 的二十面体来组成六方晶系的α-菱形硼。
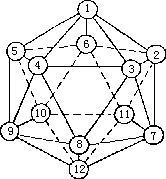
图 4-13 硼等 20 面体结构单元2.B2H6 乙硼烷中能形成氢桥键(见下一节)。
-
有加合性,譬如 BF3 与 HF 作用时,由于 BF3 是缺电子化合物,可以接受电子对形成配合物 F3B←FH。
-
硼酸是一元弱酸
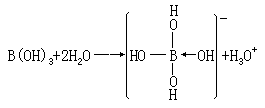 H3BO3
从形式上看似乎是三元酸,根据实验测得硼酸的 Ka=5.8×10-10,
相当于 HCN
的强度,它在溶液中表现为一弱酸,它显酸性是由于配合氢氧根离子,而不是给出质子:
H3BO3
从形式上看似乎是三元酸,根据实验测得硼酸的 Ka=5.8×10-10,
相当于 HCN
的强度,它在溶液中表现为一弱酸,它显酸性是由于配合氢氧根离子,而不是给出质子:
这种离解方法,也表现了硼化合物缺电子的特性。
在元素周期表上除了硼原子具有缺电子特性外,铝、铍等元素的原子均具有缺电子特性。所谓缺电子性是指在形成共价键时,已获得三个电子,达到了 3 对外层电子结构,离形成 8 电子稳定结构还缺一对电子。
下一篇:硼的制备和重要化学性质
