超氧化物
钾、铷、铯在过量氧气中燃烧即得超氧化物 MO2,将 O2 通入 K、Rb、Cs 的液氨溶液也能得到它们的超氧化物。KO2 是橙黄色固体,RbO2 是深棕色固体,CsO2 是深黄色固体。超氧化物中含有超氧离子 O2-。
其分子轨道表示式为:(σ ) 2(σ * )2 (σ ) 2 (σ ) 2 (π *)
4(π *)3 。
其结构为:
2s 2s 2p
2p 2 p
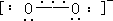
有一个σ键和一个三电子π键,它是顺磁性的。超氧化物是强氧化剂, 能和 H2O、CO2 反应放出 O2
2MO2+2H2O→O2+H2O2+2MOH
4MO2+2CO2→2M2CO3+3O2
因此被用作供氧剂。
由于O2- 、O- 反键轨道上的电子比O 多,所以O 2- 、O- 的键能小于
2 2 2 2 2
O2(分别为 142、398 及 498kJ·mol-1),因此它们的稳定性较差。
