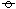表 3—7 氮族氢化物的性质
|
名称 氨 |
化学式 NH3 |
熔点/K 195.3 |
沸点/K 239.6 |
Δ fH -4.63 |
说明 空气中稳定、强热分解 |
|---|---|---|---|---|---|
|
磷化氢 |
PH3 |
141 |
185.6 |
9.25 |
不纯燃烧、热分解 |
|
砷化氢 |
AsH3 |
156 |
210.5 |
171.6 |
加热分解 |
|
锑化氢 |
SbH3 |
185 |
254.6 |
342.4 |
受热爆炸性分解 |
|
铋化氢 |
BiH3 |
— |
290 |
— |
室温自动分解 |
它们的碱性依次递减,NH3 是弱碱,PH3 是极弱的碱,AsH3、SbH3 没有碱性。
所有这些氢化物均为强还原剂,还原性依次增大(ϕφ
值分别为
0.27V,-0.063V,-0.255V,-0.510V,-0.97V)。它们同许多金属离子(如Ag+,Cu2+)溶液反应生成磷化物、砷化物或锑化物,或者这些化合物同该金 属的混合物。
氧化态为+5 的氧化物及其水合物都呈酸性,且酸性依次减弱: HNO3 H3PO4 H3ASO4 H[Sb(OH)6] HBiO3(?)
pKa -1.34 2.22 2.2 2.55 —
这种递变规律对于氧化态为+3 的相应化合物来说更明显(除 HNO2 外) H3PO3 H3AsO3 Sb(OH)2 Bi(OH)3
中强酸 两性偏酸 两性偏碱 弱碱