碱金属、碱土金属离子的配位性
碱金属离子由于离子构型的特点,形成稳定的配合物很少。但有一类多基螯合配体—环状多醚,形似皇冠亦称冠醚,能与碱金属离子形成特殊稳定的配合物。冠醚中的氧原子有固定的几何形状,中间有腔空。图 6—2 中(a) 是 18—冠—6。因它是 18 元环组成,其中有 6 个氧原子。(b)是两个小的冠醚,12-冠-4,及 15-冠-5
当金属离子的大小与冠醚腔空大小匹配时,金属离子和氧原子作用强烈,能形成稳定的大环配合物,表 6-8 列出三个冠醚中心腔空大小和金属离子的直径。
冠醚与碱金属离子的配位有高度的选择性,由于金属离子大小不同,水化能不同,与冠醚中的氧结合强弱是不同的,一般水化能大的碱金属离子与冠醚结合较弱。碱金属离子与冠醚的配位性
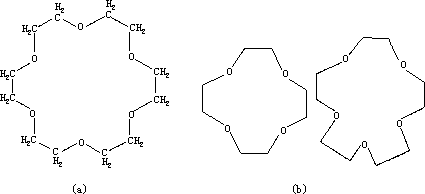
图 6-2 三种腔空大小不同的冠醚与碱金属离子的键合
表 6-8 金属离子与冠醚腔空大小的比较
金属离子 直径/pm 冠醚 腔空大小/pm
Li+ Na+ K+
Rb+
+
Cs
120
190
266
296
338
12-冠-4
15-冠-5
18 —冠— 6
100-130
170 — 220
260 — 320
在生命体系中有很大的意义。最有用的是 Na+和 K+键合抗菌素(缬氨霉素) 占据细胞壁位置,杀死细菌,同时缬氨霉素能提供通道,允许 K+通过细胞, 保持正常的离子平衡。缬氨霉素有类似冠醚的环状结构(其中有 6 个羟基氧能与金属离子配位),它与 K+结合强度大于 Na+1000 倍。另外 Li+能与有高度亲力、带有脂肪链、腔空合适的冠醚形成的大环配合物可用以治疗神经错乱症。此外还可用于碱金属离子的分离。
碱土金属离子与碱金属相似,也仅能与某些螯合剂形成配合物。明显的是与多磷酸阴离子形成配合物作为软水剂(见第三章氮族元素),也能与 edta 螯合形成稳定的配合物:
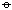 Ca2++edta4-→[Ca(edta)]2-
Ca2++edta4-→[Ca(edta)]2-
ΔrG =-60kJ·mol-1
还能与大环配体形成配合物,如叶绿素就是 Mg+和大环配体卟啉的配合物。
6.l.7 锂和铍的特殊性和对角线规则
位于二周期的锂、铍与 IA、ⅡA 族其它金属及其化合物在性质上有明显的区别。由于它们的原子体积很小并具有 2 电子构型的结构,核对外层电子屏蔽作用很小,表现出有高的电离能。使锂、铍的许多化合物中的键是共价键而不是离子键。体积很小的 Li+和 Be2+具有很高的“电荷/半径”比,因此对其它离子和极性分子产生特别强的吸引力。这种吸引力导致晶格能和水化能均很高,这是造成锂、铍离子型化合物的许多反常性质的原因。
锂、铍与同族元素性质差异很大,但它们许多性质却与镁、铝相似。锂、镁相似性表现在:
-
锂和镁在过量的氧中燃烧时,并不形成过氧化物,而生成正常的氧化物。
-
锂和镁直接和碳、氮化合,生成相应的碳化物或氮化物。
-
Li+和 Mg2+离子都有很大的水合能力。
-
锂和镁的氢氧化物在加热时,可分解为 Li2O 和 MgO
-
锂和镁的硝酸盐在加热时,均能分解成相应的氧化物 Li2O、MgO 及 NO2 和 O2。
-
锂和镁的某些盐类和氟化物、碳酸盐、磷酸盐等,均难溶于水。
-
锂和镁的氯化物能溶于有机溶剂如乙醇中。铍、铝相似性表现在:
-
两种金属的标准电极电势相近(Be2+/Be,-1.85V;Al3+/Al,-1.66V)。
-
铍和铝经浓硝酸处理都表现钝化。
-
铍和铝都是两性元素。
-
BeO 和 Al2O3 都有高熔点和高硬度。
-
铝和铍的氯化物是共价分子,能通过氯桥键形成双聚分子,可升华,
能溶于有机溶剂。
锂和镁、铍和铝与硼和硅相同,它们的相似性都符合对角线规则:

这个关系可用离子极化概念粗略地说明,由于 Li—Mg、Be-Al,B—Si 它们的离子势(电荷/半径)数据分别为:Li+9.6,Mg2+13.1;Be2+21.8, Al3+31.0;B3+60,Si4+69.4 较相近,故性质相似。
6.1.8 碱金属,碱土金属的生物作用
所有碱金属(除钫以外)都广泛存在于各种生物中,锂、铷、铯在大多数有机体中含量比钠、钾低。这三个元素中,最重要的是锂,因为有些植物
(如烟草)没有锂就长不好。锂对高等动物的神经系统肯定有作用。根据这种作用精神科医生用碳酸锂治疗狂郁精神病。
钠和钾都是动物的必需元素,但植物只需要钾而不需要钠。欲使植物生长好就要施以钾肥硝酸钾等(目前生产的钾化合物中约 80%用于钾肥)。动物吃植物可以得到钾,而动物所需要的钠则必须从食盐摄取。食盐不仅是调味品,而且可以提供氯,以产生胃液中的盐酸成分,调节和维持血液中的酸碱度。人体内的钠总量约为 90g,钾约为 160g。钠的主要功能是维持细胞内外的渗透压。钾主要是维持细胞的新陈代谢,它们都保持神经细胞对外界刺激的反应正常。研究表明,细胞外的 Na+浓度要比细胞内约大 100 倍,而 K+ 的浓度分布则相反。当神经细胞收入 Na+放出 K+时,犹如完成了一个脉冲, 这就是人体对外界刺激作出迅速反应的道理。因此,人体缺乏钠和钾会发生血液循环障碍及神经反应迟钝等症状。
在碱土金属元素中,只有钙和镁有明显的生物作用,其余都有不同程度的毒性。早就知道,铍的化合物有剧毒,即使低于致死量的铍也会引起严重的中毒症状。经常接触含铍粉尘,可以引起溃疡和癌。
生命世界中最重要,最基本的过程是植物的光合作用,它是使 CO2 和 H2O 转化为糖和氧气的极复杂过程,可简单表示为:
6CO2 + 6H2 O 日光→ C6 H 12O 6 + 6O2
这一过程离不开叶绿素(镁的复杂环状化合物)的作用。
成人一般每天需摄取镁约 300mg,镁是维持肌肉弹性所必需的,对神经机能也有帮助,且能促进碳水化合物与氨基酸代谢酶的活化。镁在人体里主要集中在细胞里面。由以上可知,人体对外刺激作出迅速反应时,靠神经细胞膜使 Na+和 K+一进一出传递神经脉冲的,而主管这种“进出开关”的是一种金属含镁的聚磷酸腺苷酶(ATP 酶),其中镁是这种酶的激活剂。人缺镁会引起血管硬化与心脏疾病,严重营养失调、胰腺及肾脏疾病等。一般人可以从食物中摄取足够量的镁。
成人日常需钙的量约 800mg,与镁相反,钙存在于细胞外面,主要集中于骨骼中。骨骼和牙齿的形成类似于钢筋水泥:先由一种胶原蛋白组成网架, 然后磷酸八钙 Ca8H2(PO4)6·6H2O 铺在这种网架上,并慢慢变成羟基磷灰石Ca5(PO4)3(OH)。所以,钙对于胎儿及儿童发育成长至关重要。由于很多钙如 Ca2(PO4)3、CaHPO4、CaCO3、CaC2O4 等难溶于水,因此从食物中摄取钙难于吸收,只有在肠胃里的酸度合适时,才能形成易溶的磷酸二氢钙等被吸收利用。此外,由于钙在人体内的输送是靠维生素 D 及某种激素控制的,因此对于欲补充体内钙的人来说,只有服用钙片的同时补充适当的维生素 D 才能达到目的。
人们在呼吸,说话、运动及消化等活动中都有肌肉收缩,而指挥肌肉收缩的也是钙离子。钙与衰老有关,钙在细胞内外浓度比维持在 1/5000 左右, 当细胞内液钙浓度增加,细胞内外钙浓度梯度大即细胞熵值增大,机体逐渐衰老。当熵值最大时,机体死亡。总之,钙是强壮骨骼与牙齿所必需,它也有助于心跳的调节、血液的凝结、神经的传导等功能,还能消除紧张、防止失眠。
