表 7—4 铜族元素电势图ϕ /V
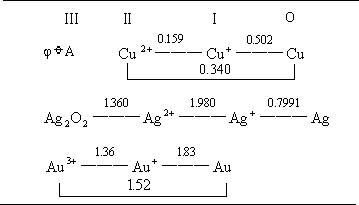
三种金属的标准电极电势都在氢之下(见表 7-4),它们不溶于稀盐酸及稀硫酸中。但当有空气或配位剂存在时,铜能溶于稀酸和浓盐酸:
2Cu+2H2SO4+O2→2CuSO4+2H2O
2Cu+8HCl(浓)→2H3[CuCl4]+H2↑
铜与银很容易溶解在硝酸或热的浓硫酸中,而金只能溶于王水中。这时, 硝酸作为氧化剂,盐酸作为配位剂:
Cu+2H2SO4(浓)→CuSO4+SO2+2H2O 3Ag+4HNO3→3AgNO3+NO+2H2O Au+4HCl+HNO3→HAuCl4+NO+2H2O
铜在常温下不与干燥空气中的氧化合,加热时能产生黑色的氧化铜。银、金在加热时也不与空气中的氧化合。在潮湿的空气中放久后铜的表面会慢慢生成一层铜绿
2Cu+O2+H2O+CO2→Cu(OH)→Cu(OH)2·CuCO3 银、金则不发生这个反应。铜、银能和 H2S、S 反应:
4Ag+2H2S+O2→2Ag2S+2H2O
金则不能。
铜族与碱金属元素性质不同的内在原因在于它们电子构型的不同。铜族元素次外层比碱金属多 10 个 d 电子。由于 d 电子屏蔽核电荷的作用较小,致使铜族元素的有效核电荷比相应的碱金属元素增大,核对价电子吸引力增强,第一电离能增大,活泼性比碱金属差。从表 7—5 铜族元素与碱金属元素的比较中可清楚地看出它们的变化规律。
由表 7—5 还可看到铜的第二、第三电离势较银低得很多。这是由于铜族元素的(n—1)d 轨道刚填满,刚填满的■能级还不稳定,与 ns 轨道能极差小。因此,d 电子参与成键,能形成大于族数的+2、+3 氧化态化合物。它的多变价体现了过渡元素的特性。
上一篇:化学性质
