对苯转变成环乙烷的探索安徽省肥东师范 张开源
对苯分子的结构,德国化学家凯库勒经过多年的研究,付出许多的心血, 终于在 1865 年找出了苯的环状结构。它的结构如下:
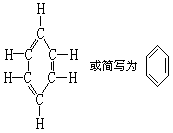
从这样的结构式来推测,苯环好像是由单、双键交替组成的,苯应该显示不饱和烃的性质。通过实验说明苯跟 KMnO4 溶液或溴水都不起反应。由此可知,苯跟一般烯烃在性质上有很大的差异,苯分子里不存在一般的碳碳双键。
 对苯的结构作进一步的研究后知道,苯分子具有平面的正六边形结构。各个键角都是
120°,六角环上碳碳之间的键长都是 1.40×10-10 米。因此,
我们应充分认识到苯环上的碳碳间的键是一种介于单键和双键之间的独特的键。在使用时绝不应认为苯是单、双键交替组成的环状结构。为了表示苯分子结构这一特点,它的结构简式也可以这样表示:
对苯的结构作进一步的研究后知道,苯分子具有平面的正六边形结构。各个键角都是
120°,六角环上碳碳之间的键长都是 1.40×10-10 米。因此,
我们应充分认识到苯环上的碳碳间的键是一种介于单键和双键之间的独特的键。在使用时绝不应认为苯是单、双键交替组成的环状结构。为了表示苯分子结构这一特点,它的结构简式也可以这样表示:
苯分子为什么是这样的结构呢?
按照杂化轨道理论,苯分子里六个碳原子的电子都以 SP2
杂化轨道相互重叠,形成六个碳碳的σ键,又各以一个 SP2
杂化轨道分别跟氢原子 1S 轨道进行重叠,形成 6 个碳氢的σ键,由于是
SP2 杂化,所以键角是 120°,并且所以 6 个碳原子和 6
个氢原子都是在同一平面上相互连接起来的。苯环上六个碳原子各有一个未参加杂化的
2P
轨道,它们垂直于环的平面,并以侧面相互重叠形成一个闭合的大π键。这样π键电子云为
6 个碳原子所共用,所以它的结构简式可以这样表示:
 。对于这种结构简式可以解释:苯环上碳碳间的键是一种介于单键和双键之间的独特的键,中间的圆圈表示大π键电子云为
6 个碳原子所共用。
。对于这种结构简式可以解释:苯环上碳碳间的键是一种介于单键和双键之间的独特的键,中间的圆圈表示大π键电子云为
6 个碳原子所共用。
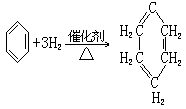 苯在特殊情况下能发生加成反应。例如,在镍为催化剂,温度为
180℃~ 250℃的条件下,1 摩尔苯可以跟 3 摩尔 H2 发生加成反应,生成 1
摩尔环乙烷。反应的化学方程式如下:
苯在特殊情况下能发生加成反应。例如,在镍为催化剂,温度为
180℃~ 250℃的条件下,1 摩尔苯可以跟 3 摩尔 H2 发生加成反应,生成 1
摩尔环乙烷。反应的化学方程式如下:
苯分子的结构既然没有双键,为什么 1 摩尔的苯跟 3 摩尔 H2 发生反应呢?我们是否可以用杂化轨道的理论来解释这个问题呢?
苯在没有反应前,苯分子里碳原子的四个能成键的电子进行 SP2 杂化, 其余一个 P 轨道保持原状,没有参加杂化。在镍为催化剂,温度为 180℃~ 250℃的条件下,苯分子里碳原子的四个能成键的电子吸收能量,发生了 SP3 杂化。这样,六个碳原子的电子都以 SP3 杂化轨道相互重叠,形成六六碳碳的σ键,又各以一个 SP3 杂化轨道,分别跟原先的六个氢原子的 1S 轨道进行重叠。这样,每个碳原子剩下的一个 SP3 杂化轨道就可以分别跟六个氢原子的 1S 轨道进行重叠,再形成 6 个碳氢的σ键。所以,1 摩尔苯可以跟 3 摩尔氢气发生反应生成 1 摩尔饱和环烃环乙烷。对于环乙烷来说,由于成环的六个碳原了并不在同一平面上,C—C—C 键角仍可维持 109°28′。故环乙烷比交稳定。另外,由于六个碳原子形成了环,C—C 单键的自由旋转受到限制, 故环乙烷应有两种结构简式:一为船式,一为椅式。
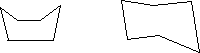 如下图所示:
如下图所示:
