分子的极性
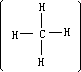 分子可分为极性分子和作极性分子。以极性共价键结合形成的分子,例如
HCl
分子中,共用电子对偏向氯原子,氯原子一端带部分负电荷,氢原子一端带部分正电荷,整个分子中电荷分布不均匀,正电荷重心和负电荷重心不重合,分子形成偶极,这种分子叫极性分子。有些分子如氢分子中的电荷分布均匀,正、负电荷重心重合,这种分子叫非极性分子。分子有无极性与键的极性和分子的结构有关:以非极性键结合的双原子分子为非极性分子,
如 O2、Cl2、N2 等;以极性键结合的双原子分子是极性分子,如 HCl、CO 等;
极性键结合的多原子分子是否有极性,还决定于分子的空间结构,例如 CO2
是直线形分子(O=C=O),分子中两个 C=O 极性键对称地分布在碳原子的两边,
两个键的极性互相抵消,CO2
是非极性分子。三氟化硼分子
分子可分为极性分子和作极性分子。以极性共价键结合形成的分子,例如
HCl
分子中,共用电子对偏向氯原子,氯原子一端带部分负电荷,氢原子一端带部分正电荷,整个分子中电荷分布不均匀,正电荷重心和负电荷重心不重合,分子形成偶极,这种分子叫极性分子。有些分子如氢分子中的电荷分布均匀,正、负电荷重心重合,这种分子叫非极性分子。分子有无极性与键的极性和分子的结构有关:以非极性键结合的双原子分子为非极性分子,
如 O2、Cl2、N2 等;以极性键结合的双原子分子是极性分子,如 HCl、CO 等;
极性键结合的多原子分子是否有极性,还决定于分子的空间结构,例如 CO2
是直线形分子(O=C=O),分子中两个 C=O 极性键对称地分布在碳原子的两边,
两个键的极性互相抵消,CO2
是非极性分子。三氟化硼分子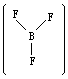 为平面
为平面
正三角形,甲烷分子 是正四面体结构,这些分子由于结构对称,
键的极性互相抵消,正、负电荷重心重合,均为非极性分子。又如水分子是 V
形分子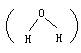 ,两个
H—O
极性键偏向分子的一端,整个分子正、负电荷重心不重合,是极性分子。氨分子呈三角锥形
,两个
H—O
极性键偏向分子的一端,整个分子正、负电荷重心不重合,是极性分子。氨分子呈三角锥形
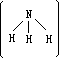 ,也是极性分子。分子的极性会影响物质的性质如溶解性,极性分子易溶于极性溶剂,非极性分子易溶于非极性有机溶剂。例如,NH3、HCl
极易溶于水,难溶于有机溶剂。而 Br2、I2 难溶于水,易溶于
CCl4,苯、汽油等。根据物质在不同溶剂中具有不同的溶解性,可用液-液萃取分离的方法分离提纯物质。
,也是极性分子。分子的极性会影响物质的性质如溶解性,极性分子易溶于极性溶剂,非极性分子易溶于非极性有机溶剂。例如,NH3、HCl
极易溶于水,难溶于有机溶剂。而 Br2、I2 难溶于水,易溶于
CCl4,苯、汽油等。根据物质在不同溶剂中具有不同的溶解性,可用液-液萃取分离的方法分离提纯物质。
