氨的化学性质
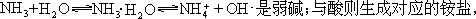 较为稳定,具碱性和弱还原性。常见反应如体现其碱性的加合,与水生成
NH3·H2O,在溶液中有平衡关系:
较为稳定,具碱性和弱还原性。常见反应如体现其碱性的加合,与水生成
NH3·H2O,在溶液中有平衡关系:
属于 NH3 的孤对电子与 H+空轨道形成配位键的加合。此外 NH3 的孤对电子与某些物质形成配位键而使氨水能溶解 AgCl、AgBr、AgOH、Ag2O 生成
Ag(NH )+ ,也能溶解Cu(OH) 2 生成Cu(NH 3 )的深蓝色可溶物。利用NH3 与
HCl 相遇出白烟(微粒 NH4Cl),可彼此互验。氨的弱还原性表现于如对 O2、
−3
Cl2 、Br2 、HClO等的反应,皆将NH 3中N 氧化为更高价态,常见反应
有:
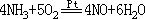

 4NH3+3O2(纯)
2N2+6H2O
4NH3+3O2(纯)
2N2+6H2O
8NH3+3Cl2 N2+6NH4Cl
