配位键
成键原子由单方面提供电子对与另一原子共用形成的共价键,配位键可表示为 A→B。例如,氨分子与氢离子结合形成铵根离子:
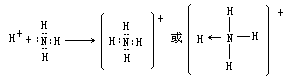
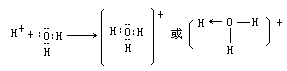 氨分子中的氮原子上有一对孤对电子,氢离子的
1s 是空轨道。NH3 与 H+反应时,N 原子上的孤对电子进入 H+的 1s 轨道,成为
N 与 H 两原子的共用电子对,形成了配位键。NH + 中的 4
个共价键是完全等同的,它们的键长、键能和键角均相等,构成正四面体的空间结构。又如水合氢离子也是以配位键形成的。
氨分子中的氮原子上有一对孤对电子,氢离子的
1s 是空轨道。NH3 与 H+反应时,N 原子上的孤对电子进入 H+的 1s 轨道,成为
N 与 H 两原子的共用电子对,形成了配位键。NH + 中的 4
个共价键是完全等同的,它们的键长、键能和键角均相等,构成正四面体的空间结构。又如水合氢离子也是以配位键形成的。
水分子中的氧原子上有二对孤对电子,其中一对进入 H+的 1s 空转道,形成了配位键。形成配位键必须具备两个条件:①一个原子要有能接受孤对电子的空轨道;②另一个原子要具有能提供的孤对电子。
配位键广泛存在,通过配位键还能形成复杂的离子(或分子)。过渡元素的离子,如 Fe3+、Cu2+、Ag+等都具有能接受电子对的空轨道,称为中心离子; 一些分子或离子,如 NH3、H2O、Cl-、CN-、SCN-等具有可提供的孤对电子, 称为配位体。中心离子与配位体通过配位键结合,形成的复杂离子叫络离子 (或配位离子),形成的中性分子叫络分子(或配位化合物)。例如:
Ag++2NH3→[Ag(NH3)2]+
银氨络离子Fe3++xSCN+→[Fe(SCN)x]3-x
第二个反应式中,x 可以是 1、2⋯⋯6。若 x=1 时,生成[Fe(SCN)]2+络离子,x=3 时,生成 Fe(SCN)3 络分子。
