共价键学说的创立
1903,J.J.汤姆生(Thomson)提出化学键的电子理论,即由于电子转移而使产生的正、负离子用静电引力而结合,这种正负理论用以解释离子型化合物如 NaCl 获得成功。但却不能解释非离子型化合物。G.N.路易斯注意到许多化合物包含的价电子数为偶数,如 NH3 含 8 个价电子,CH4 含 8 个,CO2 含 16 个,SO3 含 24 个等。他认为原子间共享两个电子则可形成一个化学键,即共价键。当原子间共享电子对使外层电子达到惰性气体的结构时,最稳定(即八隅律)。1916 年他发表了关于化学键是两个原子共享一对电子的论文。
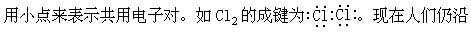
用这种表示式称为路易斯结构式。路易斯的理论解释共价化合物的成键获得成功。
1927 年海特勒(W.H.Heitler)和伦敦(F.London)首次用量子力学处理氢分子。在自旋反平行电子对成键的基础上根据原子轨道最大重叠观点,解释了共价键的本质,后为 L.鲍林(Paulimg)等发展,称为价键理论(电子配对理论)。1932 年前后,R.密立根(Millikan)等人发展了分子轨道理论,从分子整体的观点,解释共价键的本质。
