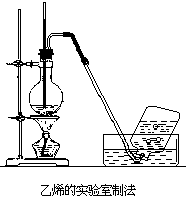
乙炔的实验室制法
实验室中常用电石跟水反应制取乙炔。电石中因含有少量钙的硫化物和磷化物,致使生成的乙炔中因混有硫化氢、磷化氢等而呈难闻的气味。在常温下,电石跟水的反应是相当激烈的,可用分液漏斗控制加水量以调节出气速度。也可以用饱和食盐水代替水,这样,可以使反应较平稳。通常,乙炔发生装置用烧瓶(或广口瓶)和插有分液漏斗及直角导气管的双孔塞组成。检查装置的气密性良好后把几块电石放入烧瓶,从分液漏斗滴水(或饱和食盐水) 即产生乙炔。如果把电石跟水的反应式写成:
CaC2+H2O→C2H2↑+CaO
是错误的。因为在有水存在的情况下,CaO 不可能是钙的最终产物,而Ca(OH)2(CaO 水化)是最终产物才是合理的。正确的化学式应是:
CaC2+2H2O→C2H2↑+Ca(OH)2
为了得到较纯净的乙炔,可以把从发生器出来的气体先经 CuSO4 溶液洗气再收集。乙炔只微溶于水,应排水收集。用电石跟水反应制乙炔不应使用启普发生器,块状电石和水在常温下即能发生反应,表面上似乎符合启普发生器的使用条件,但当关闭启普发生器的活塞时,乙炔气虽能把水压入球形漏斗以使电石跟水脱离接触,但集存在球体内的大量水蒸气(电石跟水反应放热) 却仍在缓缓继续跟电石发生反应,就是说,关闭活塞后,乙炔不能完全停止发生。这样,乙炔将缓缓从球形漏斗的上口间断逸出。平时,我们总能闻到电石有难闻的气味,就是因为电石跟空气里的水蒸气反应的结果。如果小量制取乙炔时,也可以用试管配单孔塞作反应容器,但应在试管口内松松塞一团棉花,以阻止泡沫进入导气管。