铁的化学性质
活泼,为强还原剂,化合价有 0、+2、+3、+6,最重要的价态是+2 和
 +3。在室温下,铁可缓慢地从水中置换出氢,在
500℃以上反应速度增大: 3Fe+4H2O Fe3O4+4H2↑
+3。在室温下,铁可缓慢地从水中置换出氢,在
500℃以上反应速度增大: 3Fe+4H2O Fe3O4+4H2↑
铁在干燥空气中很难跟氧气反应,但在潮湿空气中很容易腐蚀,若在酸性气
体或卤素蒸气氛围中腐蚀更快。铁可以从溶液中还原金、铂、银、汞、铜或锡等离子。与非氧化性稀酸反应,形成 Fe2+并放出氢气;在冷的稀硝酸中则形成 Fe2+和 NH4NO3:
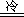 4Fe+10HNO3(
稀 ) 4Fe(NO3)2+NH4NO3+3H2O
4Fe+10HNO3(
稀 ) 4Fe(NO3)2+NH4NO3+3H2O
在热的或较浓的硝酸中,生成 Fe(NO3)3 和氮的氧化物。在冷的浓硝酸或浓硫酸中,铁的表面形成一层致密的氧化薄膜而被钝化,贮运罐车的贮酸罐和蛋形升酸器就是利用这一性质来盛贮和输送浓酸。铁与氯气在加热时反应剧烈,也能与硫、磷、硅、碳直接化合。铁与氮气不能直接化合,但与氨作用, 形成氮化铁(Fe2N)。(参看铁、二价铁离子和三价铁离子的相互转化。)
