两组分混合物中两种物质的量、质量和百分比的计算
混合物的计算属于化学方程式中较蒿层次的计算。在混合物中包括两种或多种物质,当加入一种试剂后,涉及的化学反应比较多,而且这些化学反应往往相互联系,产物中又互相交叉,计算比较复杂。对于混合物的计算, 要充分运用物质的量概念,找出多个化学反应间的联系,使计算过程简化。
[例 1] 在体积为 100 毫升氯化铜、氯化铁的混合溶液中,通入过量 H2S,
生成 1.28 克沉淀;把沉淀滤出后,在滤液里加入过量铁粉,充分反应后,滤
出过量铁粉,细心蒸发滤液,可得 7.96 克含有 4 个结晶水的天蓝色晶体。根据上述实验数据,计算原混合溶液中氯化铜,氯化铁的物质的量浓度各为多少?
[分析] 在 CuCl2、FeCl3 的混合溶液里,通入 H2S 时,CuCl2 与 H2S 发生复分解反应,FeCl3 与 H2S 发生氧化还原反应:

 CuCl2+H2S
CuS↓+2HCl 2FeCl3+H2S 2FeCl2+S↓+2HCl
CuCl2+H2S
CuS↓+2HCl 2FeCl3+H2S 2FeCl2+S↓+2HCl
通入的 H2S 过量,CuCl2、FeCl3 反应完全,上述两个反应生成的硫化铜与硫黄两种沉淀的质量之和是 1.28 克。滤出沉淀后所得滤液是 FeCl2 和 HCl 的混合溶液,在滤液中加入过量铁粉时,HCl 跟 Fe 发生置换反应:
 Fe+2HCl
FeCl2+H2↑
Fe+2HCl
FeCl2+H2↑
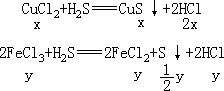 滤去过量的铁粉,得到
FeCl2 溶液,蒸发该溶液析出的含 4 个结晶水的天蓝色晶体是
FeCl2·4H2O。应当指出,跟 Fe 反应的盐酸是由 CuCl2、FeCl3 分别与 H2S
反应时生成的,溶液中的 FeCl2 包括由 FeCl3 跟 H2S 反应的还原产物与Fe 跟
HCl 反应的置换产物,溶液中 FeCl2 的物质的量与 FeCl2·4H2O
的物质的量相等。在本题中,运用物质的量概念,把 1.28 克沉淀、7.96
克天蓝色晶体与混合溶液里含有的 CuCl2、FeCl3
的物质的量联系起来,问题便可迎刃而解。[解] 设混合溶液里含有 CuCl2x
摩,含有 FeCl3y 摩
滤去过量的铁粉,得到
FeCl2 溶液,蒸发该溶液析出的含 4 个结晶水的天蓝色晶体是
FeCl2·4H2O。应当指出,跟 Fe 反应的盐酸是由 CuCl2、FeCl3 分别与 H2S
反应时生成的,溶液中的 FeCl2 包括由 FeCl3 跟 H2S 反应的还原产物与Fe 跟
HCl 反应的置换产物,溶液中 FeCl2 的物质的量与 FeCl2·4H2O
的物质的量相等。在本题中,运用物质的量概念,把 1.28 克沉淀、7.96
克天蓝色晶体与混合溶液里含有的 CuCl2、FeCl3
的物质的量联系起来,问题便可迎刃而解。[解] 设混合溶液里含有 CuCl2x
摩,含有 FeCl3y 摩
根据所得 CuS 与 S 沉淀的质量之和是 1.28 克,可以列出如下方程:
96x + 32× 1 y = 1.28 ①
2
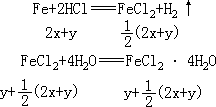 Fe
跟 HCl 的置换反应,以及 FeCl2 溶液蒸发析晶的反应及其相互关系是:
Fe
跟 HCl 的置换反应,以及 FeCl2 溶液蒸发析晶的反应及其相互关系是:
根据所得 FeCl2·4H2O 的质量是 7.96 克,可以列出如下方程:
y + 1 (2x + y) = 7.96 ②
2
解上述①②方程组得:
199
x=0.01 摩y=0.02 摩
CuCl2 的物质的量浓度为:
FeCl3 的物质的量浓度为:
0.01摩 = 0.1摩 / 升
0.1升
0.02摩 = 0.2摩 / 升
0.1升
答:原混合溶液中 CuCl2 的物质的量浓度是 0.1 摩/升,FeCl3 的物质的量浓度是 0.2 摩/升。
[例 2] 称取 NaOH、Na2CO3 的混合物 W 克,溶于水中,配成 250 毫升溶
液,移取 25 毫升至锥形瓶中,加入酚酞,以物质的量浓度为 M 的标准盐酸滴定,耗用 V1 毫升盐酸时,酚酞恰好变为无色;另取 25 毫升加入甲基橙,耗用 V2 毫升盐酸时,甲基橙由黄变为橙色。计算混合物中的 NaOH、Na2CO3 的百分含量。
[分析] 酚酞指示剂的变色范围是 pH 值 8~10,耗用 V1 毫升盐酸酚酞恰
好变为无色时,此时溶液 pH 值为 8,混合物中的 NaOH 已全部中和为 NaCl, Na2CO3 跟 HCl 反应生成 NaHCO3 和 NaCl:

 NaOH+HCl
NaCl+H2O Na2CO3+HCl NaHCO3+NaCl
NaOH+HCl
NaCl+H2O Na2CO3+HCl NaHCO3+NaCl
甲基橙指示剂的变色范围是 3.1~4.4,另取25 毫升溶液,耗用 V2 毫升盐酸, 甲基橙由黄变为橙色,此时,溶液 pH 值在 3.1~4.4 之间,混合物中 NaOH 被完全中和,Na2CO3 跟 HCl 反应生成 NaCl、H2O 和 CO2:

 NaOH+HCl
NaCl+H2O Na2CO3+2HCl 2NaCl+H2O+CO2↑
NaOH+HCl
NaCl+H2O Na2CO3+2HCl 2NaCl+H2O+CO2↑
分析酚酞和甲基橙作指示剂发生的化学反应,可知中和 25 毫升溶液中 Na2CO3 耗用盐酸的体积是 2(V2-V1);NaOH 耗用盐酸的体积是:
V2-2(V2-V1)=2V1-V2
在 25 毫升溶液中 Na2CO3 的质量是:
2(V2 − V1 ) ×M× 106 = 0.106( V − V ) M
1000 2 2 1
在 25 毫升溶液中 NaOH 的质量是:
2V1 − V2 ×M×40 = 0.04(2V − V ) M
1000 1 2
从 25 毫升溶液中含有 NaOH、Na2CO3 的质量,可以算出 W 克样品中含有的NaOH、NaCO3 的质量,进而算出它们的百分含量。

 [解]
以酚酞作指示剂发生的化学反应是:NaOH+HCl NaCl+H2O; Na2CO3+HCl
NaHCO3+NaCl。以甲基橙为指示剂时发生的化学反应是:
[解]
以酚酞作指示剂发生的化学反应是:NaOH+HCl NaCl+H2O; Na2CO3+HCl
NaHCO3+NaCl。以甲基橙为指示剂时发生的化学反应是:

 NaOH+HCl
NaCl+H2O Na2CO3+2HCl 2NaCl+H2O+CO2↑
NaOH+HCl
NaCl+H2O Na2CO3+2HCl 2NaCl+H2O+CO2↑
样品中 Na2CO3 的百分含量是:
0.106(V − V )M× 250
2 1 25
W
样品中 NaOH 的百分含量是:
×100% = 106(V2 − V1 )M ×100%
W
0.04(2V − V )M× 250
1 2 25
W
×100% = 40(2V1 − V2 )M %
W
答:混合物中Na 2 CO 3
占 106(V2 − V1 )M %,NaOH占
W
40(2V1 − V2 )M %。
W
