乙酸乙酯的的实验室制法
乙酸跟乙醇生成乙酸乙酯的反应,不但极慢,而且是可逆反应。为了加快反应速度,常用浓硫酸作催化剂并加热。
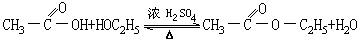
 乙酸、乙醇、浓硫酸混合加热后,混合液中除乙酸乙酯和水外,还有未反应完全的乙酸和乙醇,而它们又是混溶的。其中乙酸乙酯的沸点为
77℃,乙醇78.5℃,乙酸
117.9℃。从混合液中分离出乙酸乙酯应该用蒸馏法。规范的实验仪器为蒸馏烧瓶、冷凝器和温度计(与石油分馏装置相同),实验时,温度计控制在
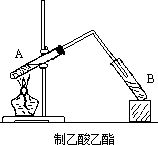
76~78℃。实验室制取很少量乙酸乙酯时,通常可以使用简易装置,如图。其中试管
A 相当蒸馏烧瓶,导管相当冷凝器(空气冷却)。在试管A 中先加入 3 毫升乙醇和
2 毫升乙酸(互溶),再加入 1~2
毫升浓硫酸,振荡均匀。先均匀加热(促进酯化反应),然后加热使混合液保持微沸腾,试管
A 里的液体逐渐减少,试管 B
中液面积存一层有香味的油状液体,这是乙酸乙酯。沸腾时,蒸气冷凝所得液态物质中,除乙酸乙酯外,尚有乙酸和乙醇,
它们是互溶的。冷凝液接触 Na2CO3
后,乙酸被中和成乙酸钠,乙酸钠属离子化合物,它只溶于水而不溶于乙酸乙酯,这样,杂质乙酸即被除去;乙醇的一部分溶于
Na2CO3
溶液的水里,另一部分仍溶在乙酸乙酯中,再用水多次洗涤乙酸乙酯,可基本把乙醇洗净。如用水或氯化钠溶液代替
Na2CO3 溶液,则乙酸乙酯的回收率明显减少。用 NaOH 溶液代替 Na2CO3
溶液也不好,NaOH
溶液会促进乙酸乙酯的水解,减少回收率,同时,不易判断乙酸是否已除净(用Na2CO3
溶液时,振荡后不再发生气泡即标志杂质乙酸已除净)。
乙酸、乙醇、浓硫酸混合加热后,混合液中除乙酸乙酯和水外,还有未反应完全的乙酸和乙醇,而它们又是混溶的。其中乙酸乙酯的沸点为
77℃,乙醇78.5℃,乙酸
117.9℃。从混合液中分离出乙酸乙酯应该用蒸馏法。规范的实验仪器为蒸馏烧瓶、冷凝器和温度计(与石油分馏装置相同),实验时,温度计控制在
76~78℃。实验室制取很少量乙酸乙酯时,通常可以使用简易装置,如图。其中试管
A 相当蒸馏烧瓶,导管相当冷凝器(空气冷却)。在试管A 中先加入 3 毫升乙醇和
2 毫升乙酸(互溶),再加入 1~2
毫升浓硫酸,振荡均匀。先均匀加热(促进酯化反应),然后加热使混合液保持微沸腾,试管
A 里的液体逐渐减少,试管 B
中液面积存一层有香味的油状液体,这是乙酸乙酯。沸腾时,蒸气冷凝所得液态物质中,除乙酸乙酯外,尚有乙酸和乙醇,
它们是互溶的。冷凝液接触 Na2CO3
后,乙酸被中和成乙酸钠,乙酸钠属离子化合物,它只溶于水而不溶于乙酸乙酯,这样,杂质乙酸即被除去;乙醇的一部分溶于
Na2CO3
溶液的水里,另一部分仍溶在乙酸乙酯中,再用水多次洗涤乙酸乙酯,可基本把乙醇洗净。如用水或氯化钠溶液代替
Na2CO3 溶液,则乙酸乙酯的回收率明显减少。用 NaOH 溶液代替 Na2CO3
溶液也不好,NaOH
溶液会促进乙酸乙酯的水解,减少回收率,同时,不易判断乙酸是否已除净(用Na2CO3
溶液时,振荡后不再发生气泡即标志杂质乙酸已除净)。
上一篇:乙炔的实验室制法
下一篇:酚醛树脂的实验室制法
