酸碱中和的计算
酸碱中和的计算属于化学方程式的计算。
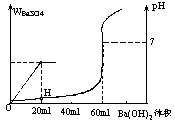 [例
1] 现有硫酸、盐酸的混合溶液 20 毫升,加入 0.05 摩/升 Ba(OH)2
溶液时,生成的 BaSO4 沉淀的质量以及溶液的 pH 值变化,与加入 Ba(OH)2
溶液的体积关系,如下图所示:
[例
1] 现有硫酸、盐酸的混合溶液 20 毫升,加入 0.05 摩/升 Ba(OH)2
溶液时,生成的 BaSO4 沉淀的质量以及溶液的 pH 值变化,与加入 Ba(OH)2
溶液的体积关系,如下图所示:
试通过计算回答下列各问:
-
A 点所表示的 BaSO4 的质量是多少克?
-
原混合溶液的 H2SO4、HCl 的物质的量浓度各为多少? (3)B 点时溶液的 pH
值是多少?
[分析] 从图象分析得知,耗用 0.05 摩/升 Ba(OH)2 溶液 20 毫升时,BaSO4
沉淀完全,根据 Ba(OH)2 的物质的量,可以算出 A 点所表示的 BaSO4 的质量; 根据 Ba(OH)2 与 H2SO4 以相同的物质的量进行反应,可以算出原混合溶液中H2SO4 的物质的量浓度。从图象看出,耗用 0.05 摩/升 Ba(OH)2 溶液(60—20) 毫升时,20 毫升混合溶液中的 HCl 恰好被中和,由此可以算出盐酸的物质的量浓度。B 点时溶液的 pH 值,是指原 20 毫升混合溶液加入 20 毫升 Ba(OH)2 溶液时,溶液中氢离子浓度的负对数,B 点时溶液的氢离子浓度,可用盐酸的物质的量除以溶液的体积(40 毫升)求出。
[解] (1)设 A 点时所表示的 BaSO4 的质量是 x 克
 H2SO4+Ba(OH)2
BaSO4↓+2H2O
H2SO4+Ba(OH)2
BaSO4↓+2H2O
1摩 = 233克
0.05摩 / 升×0.02升 x
x=0.233 克
- 设原混合溶液中 H2SO4 的物质的量浓度为 y 摩/升,HCl 的物质的量浓度为 z 摩/升
H2SO4~Ba(OH)2
1摩 =
0.02升·y
1
0.05摩 / 升×0.02升
y=0.05 摩/升2HCl~Ba(OH)2
2摩 = 1摩
0.02升·z 0.05摩 / 升×0.04升
z=0.2 摩/升
- B 点时溶液的氢离子浓度是:
[H + ] = 0.20摩 / 升×0.20升 = 0.10摩 / 升
0.20升 + 0.20升
B 点时溶液的 pH 值是:
Ph=-lg[H+]=-lg0.10=1
答:A 点表示的 BaSO4 质量是 0.233 克,原混合溶液中 H2SO4 的物质的量浓度是 0.05 摩/升,HCl 的物质的量浓度是 0.20 摩/升。
[例 2] 把 80 毫升氢氧化钠溶液加入到体积为 120 毫升、物质的量浓度
与氢氧化钠溶液相同的盐酸中,所得溶液的 pH 值为 2,计算盐酸和氢氧化钠溶液的物质的量浓度。
[分析] 氢氧化钠溶液与盐酸溶液混合,发生中和反应
 NaOH+HCl
NaCl+H2O
NaOH+HCl
NaCl+H2O
混合后溶液的 pH 值等于 2,氢离子浓度为 0.01 摩/升,说明盐酸过量,用过量的盐酸的物质的量,除以混合溶液的体积,等于混合溶液的氢离子浓度。依据这一关系就可求出盐酸和氢氧化钠溶液的物质的量浓度。
[解] 设盐酸和氢氧化钠溶液的物质的量浓度为 x 摩/升
当 pH=2 时,[H+]=1×10-2 摩/升。80 毫升 NaOH 溶液跟 120 毫升相同物质的量浓度的盐酸混合,溶液的 pH 值等于 2,则有
120x − 80x = 0.01
120 + 80
x=0.05 摩/升
答:该盐酸和氢氧化钠溶液的物质的量浓度均为 0.05 摩/升。
