电离方程式
表示电解质离解成自由离子的式子。在水溶液中,强电解质完全电离, 用等号表示,例如:
Al (SO ) == 2Al3+ + 3SO2-
2 4 3 4
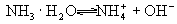
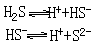 弱电解质部分电离,存在电离平衡,用可逆号表示,例如:
多元弱酸的电离是分步进行的,以第一步为主,例如:
弱电解质部分电离,存在电离平衡,用可逆号表示,例如:
多元弱酸的电离是分步进行的,以第一步为主,例如:
多元弱碱的电离也是分步进行的,一般简化为一步,例如:
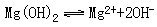
注意区别:①强酸的酸式盐和弱酸的酸式盐表示方法不同,例如:
KHSO == K+ + H+ + SO2-
4 4
NaHCO == Na + + HCO-
3 3
②复盐和络盐表示方法不同,例如:
Kal(SO ) == K+ + Al 3+ + 2SO2- (复盐)
4 2 4
K3 [Fe(SCN)6 ] == 3K+ + [Fe(SCN) 6 ]3- (络盐)
多数离子化合物在熔化时也能发生电离,表示方法如下:
NaCl( 熔融) == Na+ + Cl-
K2 O(熔融) == 2K+ + O2-
