乙烯的结构
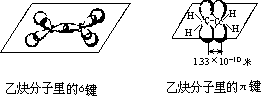
实验表明,乙烯分子里的 C=C 双键的键长是 1.33×10-10 米,乙烯分子里的 2 个碳原子和 4 个氢原子都处在同一个平面上。它们彼此之间的键角约为120°。乙烯双键的键能是 615 千焦/摩,实验测得乙烷 C—C 单键的键长是
1.54×10-10 米,键能 348 千焦/摩。这表明 C=C 双键的键能并不是 C—C 单键键能的两倍,而是比两倍略少。因此,只需要较少的能量,就能使双键里的一个键断裂。这是乙烯的性质活泼,容易发生加成反应等的原因。
在形成乙烯分子的过程中,每个碳原子以 1 个 2s 轨道和 2 个 2p 轨道杂化形成 3 个等同的 sp2 杂化轨道而成键。这 3 个 sp2 杂化轨道在同一平面里, 互成 120°夹角。因此,在乙烯分子里形成 5 个σ键,其中 4 个是 C—H 键(sp2
 —s)1
个是 C—C 键(sp2—sp2);两个碳原子剩下未参加杂化的 2 个平行的 p
轨道在侧面发生重叠,形成另一种化学键:π键,并和σ键所在的平面垂直。如:乙烯分子里的
C=C
双键是由一个σ键和一个π键形成的。这两种键的轨道重叠程度是不同的。π键是由
p
轨道从侧面重叠形成的,重叠程度比σ键从正面重叠要小,所以π键不如σ键牢固,比较容易断裂,断裂时需要的能量也较少。
—s)1
个是 C—C 键(sp2—sp2);两个碳原子剩下未参加杂化的 2 个平行的 p
轨道在侧面发生重叠,形成另一种化学键:π键,并和σ键所在的平面垂直。如:乙烯分子里的
C=C
双键是由一个σ键和一个π键形成的。这两种键的轨道重叠程度是不同的。π键是由
p
轨道从侧面重叠形成的,重叠程度比σ键从正面重叠要小,所以π键不如σ键牢固,比较容易断裂,断裂时需要的能量也较少。
