一、引导学生深刻领会氧化还原反应的本质
- 以辩证唯物主义思想为指导,揭示反应遵循着矛盾对立统一规律
第一步以金属纳和氯气化合生成氯化钠为例,用原子结构简图分析钠原子和氯原子的结构特征,得出钠与氯在一定条件下发生化学反应的必然性, 而这种反应发生的原因正是由于电子的得失而造成的。得与失的相反过程以及它们共存于同一体,正符合了“事物发展过程中的每一种矛盾的两个方面各以和它对立着的方面为自己存在前提,双方共处于一统一体中。”它也形象地说明了中国古代“相辅相成”这一成语的内涵。
反应方程式及反应发生的历程可表示如下:
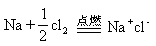
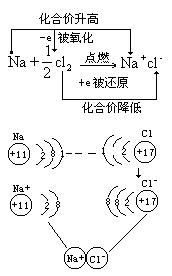 用单线桥表示反应中电子的得失。
用单线桥表示反应中电子的得失。
用双线桥表示反应的本质。
在学生由直意的氧化还原反应过渡到用电子得失表示氧化还原反应本质时,为了加深大多数学生的印象,笔者编写了几个字来帮助同学记忆氧化还原反应的概念,这几个字是:“升、失、氧,还原剂;降、得、还,氧化剂。”第二步,用氢气和氯气的化合生成氯化氢为例,说明有些反应不是由于
电子得失,而是共用电子对的偏移也发生了化合价的升降,牵扯到共价键与离子键的区别与联系。离子键与共价健之间并没有严格的界限,极性共价键再向前跨进一步即成离子键,量的变化最终导致质的飞跃。
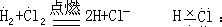
从以上的分析得出氧化还原反应的本质除反应中电子的得失外,共用电子对的偏移也引起氧化还原反应的发生。
- 帮助学生理顺有关氧化还原反应中的系列概念用语。
开始学习氧化还原反应时,由于在教材中或有关参考材料中出现一些不统一的用语,容易使学生混淆概念,为了加深对概念的理解,对一些同范畴的用语,笔者作了如下归属:
①氧化、被氧化、氧化了。这三者均指某元素或物质失去电子的过程, 例如:
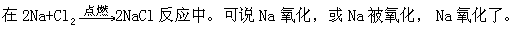
②还原、被还原、还原了。这三者均指某元素或物质得到电子的过程。例如:
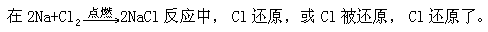
③氧化剂、氧化性、氧化能力。氧化剂是指在反应中夺得电子的物质, 它能使对方的元素或物质氧化,因而氧化剂具有氧化性或氧化能力。例如: Cl2 因②的反应中,Cl 原子得到电子,是氧化剂;它使 Na 氧化,因而 Cl2 具有氧化性或氧化能力。氧化剂愈容易得到电子,则氧化性愈强或氧化能力愈强。
④还原剂、还原性、还原能力。还原剂是指在反应中,失去电子的物质, 它能使对方的元素或物质还原,因而还原剂具有还原性或还原能力。例如在
②的反应中,Na 失去电了还原剂,它使 Cl2 还原,因而 Na 具有还原性或还原能力。还原剂愈容易失去电于,则还原性愈强或还原能力愈强。
注:当元素处于中间价态时,既有氧化性又有还原性,它跟强氧化剂反
应时,被氧化至相邻的高价态;它跟强还原剂反应时,被还原到相邻的低价态。如:

二、关于氧化还原反应的判断及训练中的两点做法1.归纳氧化还原反应常见的类型
 ①氧化剂与还原剂之间的反应
①氧化剂与还原剂之间的反应
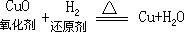
②部分氧化还原反应:
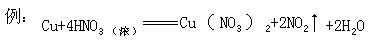
反应中 HNO3 除此氧化剂外还起酸的作用,此反应只有 2 摩的 HNO3 被还原。
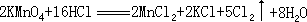
反应中被氧化的 HCl 为 10mol。
③氧化剂或还原剂中有多种成分起作用:
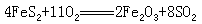
FeS2 里 Fe 和 S 都起着还原作用。
④自身氧化还原反应:
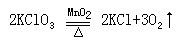
氧化剂和还原剂必须是同一种物质,可以是同种元素也可不是同种元素。
⑤歧化反应:
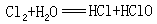
氧化、还原作用是发生在同一分子内和同一种元素上,即该元素的原子一部分被氧化,另一部分被还原。这种自身氧化还原反应称为歧化反应。
2.配平氧化还原反应方程式中,运用氧化数的好处
氧化数也叫氧化值或氧化态,它是物质分子表现所带电荷数。氧化数是在化合价概念的基础上发展起来的。如果学生基础较好,完全可以在配平训练时推出氧化数的概念。
化合价的概念是比较古老的,但它仍然是研究物质组成最基本和必要的理论。氧化数这一概念的提出和建立弥补了化合价本身的局限性,有些化合价理率解释不了的现象,可以用氧化数得到充分地回答。为了证明氧化数这种特殊的作用,下面先将化合价与氧化数的规则作简要对比。
①在单质中,元素的化合价与氧化数都为零;
②在一般情况下,氢元素的化合价与氧化数均为+1,氧元素的化合价与氧化数均为-2;
③在离子化合物中,离子的化合价与氧化数相同;
④在化合物分子中,所有原子的氧化数之和等于零,在一般的化合物中
(不是所有化合物)元素的正价总数与负价总数的代数和等零。
在一些复杂的共价化合物中,元素的化合价和化学键的关系不十分明确,对于这样的化合物,应用上述化合价规则得出来的化合价叫“表现化合价”,计算出来的“表现化合价”可以是分数,而一般的化合价是不能为分数的,这种“表现化合价”与元素之间所形成的共价数显然是两回事,这也就是氧化数与化合价最大的区别。例如:Fe3O4 分子中,Fe 的化合价数从分子式看不出,把它写成 Fe2O3·FeO,可以看出其中二个 Fe 原子显+3 价,一个 Fe 原子显+2 价。但是,用氧化数来表示,则在
Fe3O 4
中Fe原子的氧分数为 + 8 。
3
在氧化还原的教学中,如果我们单纯的从元素化合价的变化去观察反应,计算电子转移的数目,就会遇到障碍,这时,氧化数这一概念就发挥了它的特殊作用。下面举个例子加以证明。
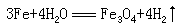
在这一氧化还原反应中,如果从化合价来判断电子得失时,则 Fe2O3 必
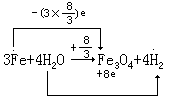 须写成
Fe3O4·FeO,在 3 个 Fe 原子中,有 2 个 Fe 原子共失去 6 个电子,1 个 Fe
原子失去 2 个电子,共 8 个电子,8 个氢原子共得到 8
个电子,如果用氧化数来表示电子的转移式则为:
须写成
Fe3O4·FeO,在 3 个 Fe 原子中,有 2 个 Fe 原子共失去 6 个电子,1 个 Fe
原子失去 2 个电子,共 8 个电子,8 个氢原子共得到 8
个电子,如果用氧化数来表示电子的转移式则为:
