六、巧妙估算
例 6 有质量和浓度都相同的稀硫酸溶液 4 瓶,各自投入足量下列物质: 甲:碳酸镁 乙:氢氧化镁 丙:氧化镁 丁:镁
完全反应后所得硫酸镁溶液浓度的大小顺序为( ) A:丁>乙>丙>甲 B:丁>甲=丙>乙
C:丙>甲=乙>丁 D:丁>甲>丙>乙
解析:本题迷惑因素是溶液浓度与生成物中是否生成有关,由于等量硫酸生成的硫酸镁质量相同,此题的关键点是写出方程式:
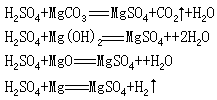
乙(两份水)>甲=丙(1 份水)>丁(没有水)故浓度大小为丁>甲= 丙>乙 答案为 B。
七、分析变量与不变量
例 7 在室温下,500 克 27.5%NaCl 溶液中含有未溶解的 NaCl M 克,加水充分搅拌至溶液质量为 1000 克时,固体质量由 M 克减到 N 克,此时 NaCl 溶液的百分比浓度是( )
M − N
A: 1000 − 500100%
B:27.5%
500 + M − N
C: 1000
×100%
D:(500×27.5% + M - N )×100%
500
分析:有些关于溶液“饱和”与“不饱和”性方面题,“饱和”含义往往隐含在题意中,要善于挖掘隐含条件,抓住“饱和”的实质,防止漏选。本题加水前后,均有未溶解的 NaCl 固体,都是室温下的 NaCl 饱和溶液,其溶液的浓度不变,溶解度也不变。加水前溶液浓度应选 B,加水后溶液浓度应选 A,A 和 B 的值应相等,故应选择 A 和 B。
