污染物的环境行为及其危害
化学污染物的环境行为十分多端,但可归结为以下两个方面:①进入环境的化学物质通过溶解、挥发、迁移、扩散、吸附、沉降等物理过程或物理化学过程,分配散布在各环境圈层(水体、大气、土壤)之中。与此同时, 又与各种环境因子(主要是水、空气、光辐照,微生物和别的化学物质等) 交互作用,并发生各种化学的、生物的变化过程。经历了这些过程的化学物质,就发生了形态和行为的变化。②这些化学物质在环境中形迹所到之处, 也留下了它们的印记,使环境质量发生一定程度的变化,同时引起非常错综复杂的环境生态效应。对以上叙述可用如下图式表示。
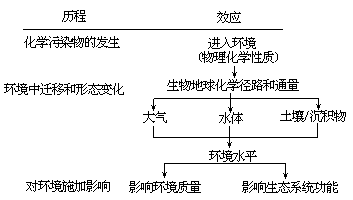
表 1-6 列举了化学污染物环境行为的几个方面,显示了它们的物理化学性质与其环境行为之间的关系。需要作说明的是表中的分配系数的概念。化学污染物的分配系数一般在正辛醇-水体系中予以测定,因为正辛醇分子中含有一个亲水基团 OH 和一个含有 8 个碳原子的直链烷烃疏水基团,结构规则, 性质稳定,不易挥发,因此用正辛醇-水系统能较好地模拟生物系统。
表 1 — 6 化学污染物的性质与其环境行为之间的关系
|
物理化学性质 |
环境中显示的行为 |
|||||
|---|---|---|---|---|---|---|
|
迁移性 |
分解性 |
累积性 |
毒性 |
|||
|
大气 水 大气 水 土壤 土壤 |
光分解 土壤中 |
水中细菌 |
非生物 |
生物 |
||
|
分子量 |
○ ○ ○ |
○ ○ |
○ |
○ ○ |
+ | |
|
波谱(分子结构) |
△ + |
+ |
+ | + | + | |
|
熔点 |
○ ○ |
○ ○ |
○ ○ |
+ | ||
|
沸点 |
○ ○ ○ |
○ ○ |
○ ○ |
+ | ||
|
蒸汽压 |
○ ○ |
+ |
+ |
+ |
+ | |
|
水溶性 |
○ ○ △ |
+ + |
○ |
+ | + | + |
|
吸附/脱附 |
△ △ |
+ △ |
△ |
|||
|
分配系数(辛醇/水) |
+ |
△ | ○ | + | ||
|
挥发性 |
△ △ |
+ + |
+ |
|||
|
生成络合物能力 |
+ △ + |
+ |
+ |
|||
|
密度 |
△ △ | + | + | + | ||
|
粒度和形状 |
+ ○ △ |
+ |
+ |
+ |
△ | |
|
水解 |
+ |
△ △ |
△ |
+ | + | + |
|
离解常数 |
+ |
△ | + | + | ○ | |
|
存在稳定性 |
△ △ |
△ + |
+ |
+ |
+ | |
|
粘度 |
+ |
△ |
○ |
|||
|
表面张力 |
+ |
+ + |
+ | |||
|
脂溶性 |
△ | + | ||||
|
膜透过性 |
△ | △ |
现以进入环境水体的化学污染物为例,简要叙说其各种环境行为,其中属于化学性的行为也就是它们的环境化学行为。与这些行为相关的物理、化学和生物过程,有的是可逆的,有的是不可逆的,有的是快速进行的,有的是存在着动力学方面阻碍的。这些过程又都与污染物在环境中的最终归宿相关。
- 扩散迁移
进入水体的污染物,在水体中随着平流和对流而发生扩散迁移。天然水道中,各个水质点运动的方向和速度不断变化着,平流的流速就很不均匀, 但可以用平均流速来表示。污染物在水体的上层和下层之间的扩散主要与平流的平均流速有关。对流扩散与湍流、浪涌、内生波流等现象相关,情况非常复杂而且是统计性的,建立污染物对流扩散模型要牵涉到很多水力学参数,但最基本的考虑问题出发点是将其看成分子扩散,以费克扩散定律为基础,舍去大多数较次要的水力学参数,从而建立对流的扩散方程和模型。
- 颗粒物吸附和迁移
天然水体中存在着大量颗粒悬浮物,它们对疏水性的有机污染物分子具有一定的吸附捕集能力,对于离子性的物质(金属离子、有机酸和有机碱的
离解离子)则具有离子交换捕集的能力。吸附了污染物的大小颗粒在水体中的迁移情况,很大程度地决定了这些污染物的归宿。例如某些重金属在水底沉积物中高度富集就是这种吸附和迁移过程的结果。
- 挥发迁移
挥发迁移是在水和空气界面间进行的物质的物理迁移过程。一般情况下,相应于宏大环境体系的污染物浓度是很低的,而且发生在界面间的挥发过程所遇到的动力学阻碍还是较大的,所以在发生水体污染时,水体上方空气中污染物浓度一般小到可忽视程度。水体中污染物通过挥发而发生迁移时,其阻力来自界面两侧的水相和空气相,而迁移速率取决于水体和空气的湍流程度、该污染物溶解于水中的亨利常数及在接近界面区域的分子运动速度等。
- 电离
很多无机或有机的污染物分子能在水中发生电离,且电离过程发生很快,常常使体系处于可逆而又平衡的状态。例如某酸类污染物 HA 在达到电离平衡时,其中未电离部分 HA 所占的数量比例为
α0=1/(1+Ka/[H+])=[H+]/([H+]+Ka) (1-1) 已电离部分所占的比例为
(1-α0)=Ka/([H+]+Ka) (1-2)
以上两表达式中,Ka 是电离常数。除 Ka 外,电离程度主要由水体的 PH 值决定。
- 水解
盐类电离之后产生酸根离子和金属离子,它们都可能进一步水解。例如FeCl3 溶入水中后,经电离、水合生成 Fe3+水合离子,后者可在水中进一步水解,引起一系列质子迁移反应,从而使水显示酸性。反应如下:
 Fe(H2O)63++H2O
Fe(H2O)5OH2++H+
Fe(H2O)63++H2O
Fe(H2O)5OH2++H+
 Fe(H2O)4(OH)2++2H+
Fe(H2O)4(OH)2++2H+

 Fe(OH)3(H2O)3(S)+3H+
Fe(OH)4(H2O)2-+4H+
Fe(OH)3(H2O)3(S)+3H+
Fe(OH)4(H2O)2-+4H+
- 化学氧化和光化学氧化
在水体中的有机污染物分子可能受到自由基、臭氧或激发态氧分子的氧化;也可能在太阳辐照作用下,接收电磁波光子,使其分子从基态转化到激发态,从而发生光化氧化。此时,激发态分子或是与水中氧化剂直接反应, 或是发生分子开裂,形成了自由基,再发生进一步反应。光化氧化的速率取决于太阳辐射的通量、污染物分子对特定波长谱线的吸收截面和过程的量子效率。
- 生物浓集
与周围环境交换物质和摄取营养,是所有生物体的本质性机能。但在此过程中,同时也就将污染物引入体内,并可能富集积贮在某些脏器之中。经过较长一段时间的连续摄取,生物体内污染物浓度大于环境媒体中的浓度, 并达到平衡的过程就称为生物浓集。生物浓集因子 BF 为进入环境的污染物在生物体中累积浓度 cb 与在环境媒体中的浓度 Ce 在平衡状态下的比值,即
BF = cb
c e
(1 − 3)
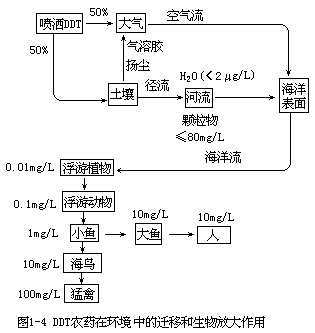
经生物浓集的污染物还可能通过食物链进一步发生生物放大作用,对居于食物链末端生物的正常机体功能构成威胁。例如 DDT 是一种人工合成的有机氯杀虫剂,几乎不溶于水,但有极强的脂溶性。它可以通过食物链高度浓集于生物的体内,使居于食物链末端人体的累积浓度比最初环境浓度高出数百万倍,对机体构成很大危害,如图 1-4 所示。
- 微生物降解
各种自然水体中所含的有机物在由微生物参与的分解过程中,逐步降解而又转化为 CO2 和 H2O,这是一种生物化学的过程。因为细菌等微生物生长繁殖需要碳、氢、氧、氮各种成分和能量,所以通过分解作为营养来源的各种有机物,可从中取得构成本身细胞的材料和活动所需的能量;另一方面,受有机物污染的水体也通过这一过程而获得净化(这称为水体的自净作用)。在有氧条件下,微生物分解水体中有机物时需要消耗水中溶解氧。在缺
氧条件下,有机物又会发生腐败发酵而恶化水质;同时水中有机物数量增多还会引起细菌繁生,容易引起病菌传播等危险性的卫生问题。所以,就水体来说,有机物是一类严重的污染物质。
- 危害性
化学污染物的危害指的是它们对人、生物或其他有价值物质所产生的现实的或潜在的危险。其主要方面可列举如下:
可燃性,如低闪点液态烃类等; 腐蚀性,如强酸,强碱等;
氧化反应性,如硝酸盐,铬酸盐等; 耗氧性,如水体中有机物等;
富营养化,如水体中含氮、磷的化合物; 破坏生态平衡,如农药等;
致癌、致畸、致突变性,如有机卤化物,多环芳烃等; 毒性,如氰化物、砷化物等。
对人体健康来说,环境污染物所引起的直接的而又至关重要的危害是它们的毒性。某些化学污染物质对人体或生物有明显的急性毒害作用,如三氧化二砷、氰化钾等被称为毒物;还有一些化学污染物在一定条件下才显示毒性者被称为毒剂。这些条件包括剂量、形态、进入生物体的途径和个体抗毒能力等。如一般铁的化合物是无毒的,但作为多种维生素添加剂的 Fe(SO4) 3,对小儿的死亡剂量为 4~10g。Cr(Ⅲ)是人体必须元素,但高价的 Cr(Ⅵ) 有很强毒性;与此情况相反,高价的 As(Ⅴ)毒性小于低价的 As(Ⅲ);同是三价砷,其氧化物 As2O3(砒霜)是剧毒的,其硫化物 As2S3(古代术士炼丹的主要原料)却是低毒的;至于元素砷,现代瑞士山区居民还把它作为强身剂服用。以蒸气形态进入人体呼吸道的汞是剧毒的,按我国车间空气标准, 汞浓度不超过 0.01mg/m3。与此相反,进入人体消化道的液态汞可通过粪便很快地全部排出体外,因而是低毒或无毒的。
