1. 气体在水中的溶解
================
在水体中的溶解性气体对水生生物类有很大的意义。例如鱼类在水体中生活时,要从周围水中摄取溶解氧(溶解氧小于 4mg/L 时就不能生存),经体内呼吸作用后,又向水中放出 CO2。对于水中藻类来说,则是通过其体内进行的光合作用,有着与呼吸作用相反的过程。又如水体中溶解氮量因某些原因增大时,会引起水中大量鱼类和其他水生生物死亡。当然,许多工业排气,如 HCl、SO2、NH3 等一旦进入水体并进一步溶解之后,也会对水体产生各种不良的影响。
溶解平衡是相对的,而偏离平衡状态的水中溶解气体(处于不饱和或过饱和状态)有在气-水两相间发生传质的趋向,由此关系到气体物质在两环境圈层间发生迁移的过程。
能溶于水并形成电解质或非电解质溶液的气体,它们的溶解度都可以用亨利定律来表述。亨利定律的内容是:“在定温和平衡状态下,一种气体在液体里的溶解度和该气体的平衡压力成正比”。用公式表示为:
[A(aq)]=KHApA(4-1) 式中 A——代表某种气体;
pA——分压;
KHA——亨利系数,在一定温度下 KHA 是常数。
天然水体中一些重要无机物气体的亨利常数列于表 4-1。一些具环境意义的有机物的亨利常数列举在附录四。
表 4-1 无机物气体在 25 ℃水中的亨利常数
|
气体 |
K ( mol/L · Pa ) H |
气体 |
K ( mol/L · Pa ) H |
|---|---|---|---|
|
O 2 |
1.28 × 10-8 1.88 × 10-8 9.28 × 10-8 9.87 × 10-8 2.47 × 10-7 3.36 × 10-7 1.00 × 10-6 1.22 × 10-5 |
HO |
2.47 × 10-4 4.84 × 10-4 6.12 × 10-4 1.97 × 10-2 2.47 × 10-2 0.70 2.07 |
|
NO |
HNO 2 |
||
|
O |
NH |
||
|
3 |
3 |
||
|
NO |
HO |
||
|
2 |
2 |
||
|
N O 2 |
HCl |
||
|
CO |
H O |
||
|
2 |
2 2 |
||
|
H S |
HNO |
||
|
2 |
3 |
||
|
SO |
|||
|
2 |
在应用亨利定律时须注意下列几点:
- 溶质在气相和在溶剂中的分子状态必须相同,否则便不能使用亨利定律。例如 CO2 溶解在水中时,经水合、电离作用后,在水中有多种存在形
态:(CO ) 、H CO 、HCO -、CO 2-,亨利定律表达式中[A ]只包含(CO )
2 aq 2 3 3 3 (aq) 2
aq 这一形态。
-
对于混合气体,在压力不大时,亨利定律对每一种气体都能分别适用,与另一种气体的压力无关。
-
对于亨利常数大于 10-2 的气体,可认为它基本上是能完全被水吸收的。
-
亨利常数作为温度的函数,有如下关系式:
d ln KH
dT
= ∆H RT2
(4 − 2)
式中,△H 为气体溶于水过程的焓变。一般△H 为负值,所以随温度降低,亨利系数增大,即低温下气体在水中有较大溶解度。对于溶解度非常大的气体, 亨利系数还可能与浓度有关。
-
亨利常数的数值可以在定温下由实验测定,也可以使用热力学方法予以推算。
-
亨利定律有几种不同表达式,应用时要注意辨别。
- 氧在水中的溶解
氧在水中的溶解度和溶解氧值是两个既相区别而又相联系的概念。氧在水中的溶解度指的是水体和大气处于平衡时氧的最大溶解浓度,它的数值与温度、压力、水中溶质量等因素有关。水中溶解氧值则一般是指非平衡状态下的水中溶解氧的浓度。它的数值与水体曝气作用、光合作用、呼吸作用及水中有机污染物的氧化作用等因素有关。这两个概念之间的差异是由于大气和水体界面间氧气传质动力过程较慢而引起的。
①氧在水中的溶解度
若已知当 25℃下水蒸气在空气中含量为 0.0313 摩尔分数以及干空气中含 20.95%O2 时,则可应用道尔顿分压定律和亨利定律算出标准条件下氧在水中溶解度[O2(aq)]:
[O ]=K ·p =1.28×10-8×(1.0000-0.0313)0×1.013×105×O.2095
=2.63×10-4mol/L(相当于 8.4mg/L)
由(4-2)式可导出在定压条件下温度对氧气在水中溶解度影响的关系式:
lg C2
= ∆H 1 − 1
C 2.303R T T
1 1 2
式中 C1 和 C2——分别为绝对温度 T1 和 T2 下气体在水中溶解度(mg/L);
△H—— 溶 解 热 (J/mol); R——气体常数(8.314J/K·mol)。
压力对氧气在水中溶解度的影响可用下列公式表述:
C2 =
C1
P2 − p 1.013×105 − p
(4 − 3)
式中 C1 和 C2——分别为标准气压和 P2 气压下氧气在水中的溶解度(mg/L); p——确定温度下饱和水蒸气的压力(p 和 P2 的单位为帕)。
水中盐分含量对氧气在水中溶解度的影响可用下列经验公式表述: 1000C=10.291-0.2809t+0.006009t2+0.0000632t3- [ Cl ] ( 0.1161-
0.003922t+0.0000631t2) (4-4)
式中 C——水中 O2 的溶解度(mL/mL); t——温度(℃),上式适用范围为 0~28℃;
[Cl]——水中含氯浓度(g/L),上式适用范围为 0~20g/L。
氧气在水中溶解度(mg/L)的数据列于表 4-2 之中。制作该表的条件是水面上总压力为标准大气压,又平衡气相为水蒸气所饱和。
表 4 — 2 水中氧的溶解度
|
温度℃ |
水中氯化物浓度( mg/L ) |
||||
|---|---|---|---|---|---|
|
0 |
5000 |
10000 |
15000 |
20000 |
|
|
0 |
14.60 |
13.72 |
12.90 |
12.13 |
11.41 |
|
5 |
12.75 |
12.02 |
11.32 |
10.67 |
10.05 |
|
10 |
11.27 |
10.65 |
10.05 |
9.49 |
8.96 |
|
15 |
10.07 |
9.53 |
9.01 |
8.53 |
8.07 |
|
20 |
9.07 |
8.60 |
8.16 |
7.73 |
7.33 |
|
25 |
8.24 |
7.83 |
7.44 |
7.06 |
6.71 |
|
30 |
7.54 |
7.17 |
6.83 |
6.49 |
6.18 |
|
35 |
6.93 |
6.61 |
6.30 |
6.01 |
5.72 |
|
40 |
6.41 |
6.12 |
5.84 |
5.58 |
5.33 |
②水中溶解氧(DO)值
水中溶解氧值是水质的重要参数之一,也是鱼类等水生动物生存的必要条件。由于各种环境因素的影响,水中 DO 值变化很大,即在一天之中也不相同。主要的影响因素有:再曝气作用、光合作用、呼吸作用和有机污染物的氧化作用。再曝气作用与水中 DO 值有关,当 DO 值与水中氧的溶解度差值越大时,氧从空气进入水中的量也越多。澎湃奔流的河水由于与空气交界面积较大,再曝气作用的过程进行得较快。水中植物体的光合作用在白昼进行, 由于过程中产生氧气,也使水中 DO 值增大。水中各类生物体的呼吸作用是全天不分昼夜地进行,并不断从水中耗用氧而使 DO 降低。图 4-1 表明一天内水体中 DO 值随上述三种作用而变化的情况。由图中曲线可知,早晨日出后,由于光合作用和再曝气作用同时发生,水中 DO 值不断上升;但过了午后,因DO 值超过了溶解度,以致再曝气过程发生逆转,氧反而从水中释出,因而曲线开始下降。傍晚日落后光合作用停止,因此曲线继续下降。
图 4-2 表明有机污染物的氧化作用和水体中 DO 值的关系。当水体污染程度较低时,好氧性细菌使有机污染物发生氧化分解而逐渐消失,因此 DO 值降低到一定程度后不再下降。但如污染比较严重,超出水体自净化能力时,则水中溶解氧耗尽,从而发生厌氧性细菌的分解作用,同时水面常会出现粘稠的絮状物使与空气隔开,妨碍再曝气作用的进行。
- 二氧化硫在水中的溶解
二氧化硫和二氧化碳在水中溶解情况有很多相似之处,对于后者将在下一节酸碱平衡中再作详述,在此仅讨论 SO2 在水中的溶解(所讨论的内容和所得结果大体适用于 CO2)。
SO2 是一种重要的大气污染物,它的气-液溶解平衡在形成酸雨的问题上有很大意义。
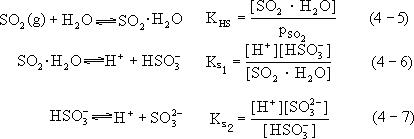 SO2
被水吸收过程中,除物理性溶解外,还发生如下系列反应:
SO2
被水吸收过程中,除物理性溶解外,还发生如下系列反应:
以上 KHs 是 SO2 的亨利常数,Ks1 和 Ks2 分别为酸的一级和二级电离平衡常数。KHs、Ks1、Ks2 数值与温度有关,可按下列各经验式求值:
1376.1
lg KHS =
T 853
− 4.521
lg Ks1 =
T − 4.74
lg Ks2
= 621.9 − 9.278
T
SO2 在水中存在的各种形态的平衡浓度可表示为
[SO2 ·H 2 O] = K HS ·pso2
[HSO− ] = Ks1 [SO2 ·H 2 O] = KHS·Ks1 ·pso 2
3 [H+] [H+ ]
Ks [HSO− ] K ·Ks ·Ks ·pso
[SO2− ] = 2 3 = HS 1 2 2
3 [H + ] [H+ ]2
根据电中性原理:
[H+]=[OH-]+[HSO -]+2[SO 2-]
将此式与上列[HSO -]、[SO 2-]等表达式相联,可得:
[H+]3-(K +K ·Ks ·pso )[H+]-2K ·Ks ·Ks ·pso =0 (4-8)
式中 Kw 为水的离子积。纯净去离子水与假想只含 SO2 的空气达到平衡时,该含酸水溶液的 pH 值可通过解以上的三次方程求得。将解得的[H+]浓度值代入上列有关方程,还可求得[HSO -]和[SO 2-]的平衡浓度。
氧化态为+4 的各有关含硫物质在水中的总浓度[S(IV)]的表达式为
[S(Ⅳ)] = [SO ·H O] + [HSO− ] + [SO2− ]
= Ks1
Ks1 ·Ks2
KHS pso2 1 + [ H+ ] +
[H + ]2
* ·pso (4 − 9)
后一个等式系将[S(IV)]浓度表达为类似亨利定律的形式。由于 KHS*
总是大于 KHS,所以水中可溶解 SO2 的实际量总是大于通过亨利定律计算所得到的数值。此外,由[S(Ⅳ)]表达式还可看出,其值取决于溶液的 pH 值、温度和 pso2。通过计算得到的图 4-3 显示出这些变量对[S(Ⅳ)]值的影响程度。在给定温度下,[SO2·H2O]浓度与 pH 值无关。但对[S(Ⅳ)]来说, 随着 pH 值增大,[S(Ⅳ)]值会有很大的提高。
S(Ⅳ)三种形态各自的摩尔分数分别为:
α ·H O = [SO2 ·H2 O] =
-
Ks1
-
Ks1·Ks2
(4 − 10)
SO 2 2
[S(Ⅳ)]
1 [ H
+ ] [H+ ]2
[HSO− ] [H+ ] Ks −1
α − = 3 = 1 + + 2
(4 − 11)
HSO 3
[S(Ⅳ)]
Ks1
[H+ ]
[SO2 − ]
[H + ] [H+ ]2
− 1
α 2−
= 3 = 1 + +
(4 − 12)
SO 3
[S(Ⅳ)]
Ks Ks ·Ks
2 1
2
由上述三式可计算溶液中 S(IV)三种形态摩尔分数随 pH 值变化而相应消长的情况。计算结果如图 4-4 所示。
上述 S(Ⅳ)的三种形态有各自不同的反应性,如果 HSO -或 SO 2-在溶
液中发生了某种化学反应,很容易理解该反应的反应速率将取决于溶液的 pH 值。
- 一氧化氮和二氧化氮在水中的溶解
一氧化氮(NO)和二氧化氮(NO2)在水中溶解的系列反应为


 NO(g)
NO(aq) NO2(g) NO2(aq) 2NO2(aq) N2O4(aq)
NO(g)
NO(aq) NO2(g) NO2(aq) 2NO2(aq) N2O4(aq)

 NO(aq)+NO2(aq)
N2O3(aq) N O 2H++NO -+NO -
NO(aq)+NO2(aq)
N2O3(aq) N O 2H++NO -+NO -
 N
O 2H++2NO -
N
O 2H++2NO -
对以上系列方程进一步合并可得:
 2NO
+H O 2H++NO -+NO -
2NO
+H O 2H++NO -+NO -
 NO
+NO +H O 2H++2NO -
NO
+NO +H O 2H++2NO -
表 4-3 列举了各反应在 298K 温度下的平衡常数。在本系统中,硝酸根离子和亚硝酸根离子间平衡浓度之比的表达式可从两反应式推得:
[NO− ] pNO K
3 = 2 · 1
(4 − 13)
[NO− ]
p NO K2
在 298K,K1/K2=0.74×107。由此可见,只要 PNO2/pNO 大于 10-5 时,就有[NO3-]》
[NO -]。由此看来,即使 NO 在气相中存在比率很小(如由燃烧过程中所产生的氮氧化合物中 NO2 只占很小比率),与之平衡的溶液中含氮离子的主要形态还是 NO -。



 表
4 — 3 氮氧化物液相反应的平衡常数
表
4 — 3 氮氧化物液相反应的平衡常数
|
反应 |
平衡常数( 298K ) |
|---|---|
(g) (aq)
2(g) 2(aq)
2(aq) 2 4(aq)
(aq) 2(aq) 2 3(aq)
|
K =1.88 × 10-5MkPa-1 H(NO) KH(NO )=1.88 × 10-4MkPa-1 2 K =7 × 104M-1 n1 K =3 × 104M-1 n2 K =15.4M n3 K =5.1 × 10-4M n4 K =2.44 × 10-2M4kPa-2 1 K =3.28 × 10-9M4kPa-2 2 |



 HNO
是强酸,在水溶液中基本上只以 NO -形态存在;HNO 是弱酸,它的
HNO
是强酸,在水溶液中基本上只以 NO -形态存在;HNO 是弱酸,它的
电离程度由 pH 值所左右,在水溶液中通常有 NO -和 HNO 两种存在形态。
2 2(aq)
以下,我们来考虑在气-液平衡条件下,水相中硝酸、亚硝酸以及它们离子形态浓度与 pNO2、pNO 之间的函数关系。
根据电中性原理有:
[H+]=[OH-]+[NO -]+[NO -]
在酸性溶液中,近似地有[H+]≌[NO -],并由此可得
K 2p3
1/4
[NO− ] = 1
NO 2
(4 − 14)
K 2 p NO
由表 4-1 中平衡反应式(7)产生的 NO -很少,若考虑水溶液中 NO -形态
全部来自于平衡反应式(8),则有
[NO− ] =
(K2
⋅ pNO ⋅ p NO
2
)1/2
2
将以上两式归并后可得
3 3
1/4
[NO− ]
[NO− ] = K 2 p NO
(4 − 15)
2 K 2p
NO
2
HNO2 未离解部分的浓度为
[HNO2 (aq)
[H+][NO− ]
] = 2
K
n4
联合以上[NO -]、[NO -]表达式及[H+]≌[NO -]式并代入上式可得
K ⋅ p ⋅ p
1/2
[HNO
] = 2
NO NO2
(4 − 16)
2 (aq) 2
n4
图 4-5 显示了作为 pNO 和 pNO2 函数的[HNO3(aq)]、[HNO2(aq)]平衡浓度的变化情况。由图可见,在平衡条件下,HNO3(aq)形态在本系统中占有极大的优势。
液态物质在水中的溶解
关于液态物质在水中溶解平衡的规则大多是定性的和经验性的。一般地说,低极性分子构成的物质或分子中不带有能形成氢键的基团的物质在水中溶解度很小。例如,与醇类具有高度水溶性的性质相反,烃类或卤代烃在水中溶解度是很小的。结构相近而分子较小的物质一般有较大的水溶性,例如苯、甲苯、邻二甲苯三者在水中溶解度递降,分别为 1.8、0.51、0.17g/L。至于苯酚、苯、环己烷,虽然它们的分子大小相近,但由于极性有较大差异, 所以在水中溶解度分别为 70、1.8 和 0.05g/L。
很多呈液态的有机物质在水中依靠分子间作用力发生物理性溶解。这种分子间作用力有两类,一类是范德华引力,这种力较小,存在于任何分子间; 另一类是氢键力,可表示为 AH⋯B,这种力较大,对溶解度有决定性意义。在氢键的表达式中,A 和 B 为电负性大,半径小的原子,如氧、硫、氟、氯、氮等;从电子授受能力来说,AH 为受电子基,如—OH、=NH、—SH 等;B 为给电子基,如—O—、=N—、—F、—S—、—Cl 等。基于上述,我们可以将溶剂分为以下五种类型:
N 型 是惰性溶剂,它们没有生成氢键的能力。如苯、甲苯、煤油、硅油、石蜡油、四氯化碳、二硫化碳、环己烷、戊烷、己烷、庚烷等。
A 型 是受电子型溶剂,分子中含 AH 基,能与给电子溶剂 B 的分子生成氢键。如氯代甲烷、氯代乙烷等。
B 型 是给电子型溶剂,分子中含 B 原子,能与另一种溶剂 AH 的分子生成氢键。如各类醚、酮、醛、腈、酯、季胺、吡啶等。
AB 型 是给受电子型溶剂,分子中同时含有 AH 基和 B 原子,因此,自身就可缔合成多聚分子。诸如水、多酚、多元醇、多元羧酸类化合物,它们自身缔合成多聚分子是通过交链氢键键合完成的,可定名为 AB1 型溶剂。另有一类 AB2 型溶剂,诸如醇、酚、伯胺、羧酸类化合物,它们自身缔合成多聚分子是通过直链氢键键合完成的:
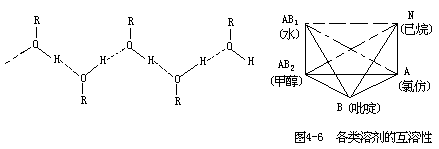
以上几类溶剂相互溶解的能力如图 4-6 所示。图中以实线相联的两类物
质是互溶的,以锁线相联者是部分互溶的,以虚线相联者是不相溶的。当然, 属于同一类的物质也是相互可溶的。从图中还可看出,作为 AB1 型溶剂的水, 可溶解 AB1、AB2 和 B 型物质,部分溶解 A 型物质,而不能溶解 N 型物质。
