-
酸-碱体系的特性
- 酸碱质子理论
在各种酸碱理论中,由布朗斯特德和劳莱于 1923 年提出的酸碱质子论是最适用于水体化学的一种理论。按这种理论对酸和碱所下的定义是:酸是一种质子给体,碱是一种质子受体。例如,在下列反应中:
 HCl+H
O Cl-+H O+
HCl+H
O Cl-+H O+
当反应自左向右进行时,HCl 起酸的作用(质子给体),H2O 起碱的作用
(质子受体)。由于质子十分微小又不能独立存在,所以在水体中往往由溶剂水分子作质子受体而生成水合氢离子 H O+。虽然上述反应朝右侧进行的趋
势十分强烈,但仍可将反应视为可逆的。如果反应逆向进行,则应将 H O+视为酸,Cl-则为碱。HCl-Cl-和 H O+-H O 实质上是两对共轭酸碱体。
另举一酸碱反应例:
 H2O+NH3
OH-+NH4+
H2O+NH3
OH-+NH4+
对这个反应来说,H2O 起了酸的作用。比较上述两个例子,可以说,水具有两重性,即它在反应中既能作酸又能作碱,全视它与什么物质作用而定。也
可以说,一种物质到底是酸还是碱,脱离了具体的反应是无法确定的。对以上两反应写成一般式就是
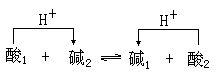
从酸碱质子理论看来,任何酸碱反应,如电离、中和、水解等都是两个共轭酸碱对之间的质子传递反应。水体中的水分子在这些过程中经常充当质子转移的中间介质。
- 酸和碱的种类
表 4-4 列举了按质子论定义的常见酸和碱。由表可见,不但一般分子可以成为酸或碱,各种正离子和负离子也可以成为酸或碱。
表 4 — 4 在水溶液中常见的酸和碱
|
酸 |
分子 |
HI , HBr , HCl , HF , HNO , HClO , H SO , H PO , H S , H O , HCN , H CO 3 4 2 4 3 4 2 2 2 3 |
|---|---|---|
|
正离子 |
[Al(H O) ]3+, NH +,[Fe(H O) ]3+,[Cu(H O) ]2+ 2 6 4 2 6 2 4 |
|
|
负离子 |
HSO -, H PO -, HCO -, HS- 4 2 4 3 |
|
|
碱 |
负离子 |
I-, Br-, Cl-, F-, HSO -, SO 2-, HPO 2-, HS-, S2-, OH-, O2-, CN-, HCO -, CO 2- 4 4 4 3 3 |
|
正离子 |
[Al(OH)(H O) ]2+,[Cu(OH)(H O) ]+,[Fe(OH)(H O) ]2+ 2 5 2 3 2 5 |
|
|
分子 |
NH , H O , N H , NH OH 3 2 2 4 2 |
有机酸碱大多是分子态化合物。作为质子给体(酸)的有酸、酚、醇、腈、酰胺等类化合物,作为质子受体(碱)的有醚、酯、酮、叔胺等类化合物。
- 酸和碱的强度
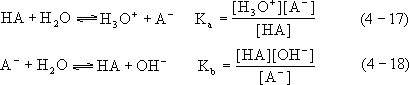 酸和碱的强度分别用酸电离常数
Ka 和碱电离常数 Kb 表示。相应地有
酸和碱的强度分别用酸电离常数
Ka 和碱电离常数 Kb 表示。相应地有
以上 Ka、Kb 表达式中已将[H2O]浓度项分别并入 Ka 和 Kb,这是因为水在体系中过量存在,它的浓度没有发生显著变化。还应指出,准确的 Ka 或 Kb 应由活度来计算,但在非常稀的溶液中基本上可用浓度来代替。由(4-17)和(4- 18)式可见,酸和碱的强度都是相对于水的共轭体系(H3O+-H2O)和(H2O-OH-)来衡量的。
为了使用方便,一般将 Ka、Kb 分别转写为 pKa、pKb:
pKa=-lgKa pKb=-lgKb
Ka 数值越大或 pKa 数值越小,则形态为 HA 的酸越强。HIO3 的 pKa=0.8,一般
定 pK <0.8 者为强酸。K 数值越大或 pK 数值越小,则形态为 A-的碱越强。H SiO 2-的 pK =1.4,一般定 pK <1.4 者为强碱。
对于共轭酸碱 HA 和 A-来说,将(4-17)、(4-18)两反应方程相联,
得
K ·K =[H O+][OH-] (4-19)
两者之积称为水的离子积 Kw,在 25℃时
K =K ·K =10-14.00
或 pKa+pKb=14.00
上式表明,共轭体系中的酸越强,则其共轭碱越弱,否则反然。以下列举一些共轭酸碱对及它们的强度次序(另见附录五、六)
 Ka
强酸 弱碱 Kb
Ka
强酸 弱碱 Kb
 55.4
H O+ H O+H+ 1.8×10-16
55.4
H O+ H O+H+ 1.8×10-16
 1.2×10-2
HSO - SO 2-+H+ 8.7×10-13
1.2×10-2
HSO - SO 2-+H+ 8.7×10-13
 1.3×10-5
CH COOH CH COO-+H+ 7.6×10-10
1.3×10-5
CH COOH CH COO-+H+ 7.6×10-10
 4.0×10-7
H CO HCO -+H+ 2.5×10-8
4.0×10-7
H CO HCO -+H+ 2.5×10-8
 5.7×10-10
NH + NH +H+ 1.7×10-5
5.7×10-10
NH + NH +H+ 1.7×10-5
 1.2×10-13
HS- S2-+H+ 8.0×10-2
1.2×10-13
HS- S2-+H+ 8.0×10-2
 1.8×10-16
H O OH-+H+ 55.4
1.8×10-16
H O OH-+H+ 55.4
 弱酸
强碱
弱酸
强碱
共轭酸碱的相对强度确定后,那么反应按什么规律进行呢?对于下列反应,A1 和 B1 以及 A2 和 B2 为共轭酸碱,若它们的强度是 A1>A2,B2>B1,则反应从左向右进行:

- 酸碱缓冲容量
向共轭酸碱体系外加别的酸[H+]或碱[OH-],并经过酸碱反应被体系消耗后,仅能引起 pH 值微小变化的事实引出缓冲作用的概念。酸碱体系的缓冲容量(β)被定义为:若使该水溶液体系的 pH 值升高一个单位所需加入强碱NaOH 的摩尔数(cB,mol/L)。β总是取正值,所以若向溶液中加入强酸(cA, mol/L),则相当于取出了同样数量的强碱。由此,缓冲容量表达式为:
β =
或 β =
dcB
dpH
∆c B
∆pH
= − dcA
dpH
= − ∆cA
∆pH
(4 − 20)
(4 − 21)
对地面水来说,一般只有很小缓冲容量,不能随意多量受纳酸碱废水, 否则将引起 pH 值很大变化,对水质和水生生物会产生很大影响。
