-
大气中硫氧化物(SO2)污染物
- 大气中 SO2 的源和汇
存在于大气中的含硫化合物可分为还原性化合物和氧化性化合物两类。还原性化合物有硫化氢、二硫化碳、二甲基硫、二甲基二硫、硫醇等,其中的硫都是最低价态的(化合价为-2)。还原性化合物的自然来源,主要是平坦沿海地区和沼泽地等的有机物质的细菌分解。例如在厌氧条件之下,某些种类的细菌为了获取氧而将周围环境中的 SO 2-还原为 H S;也有些细菌能降
解有机生物体中含硫的氨基酸,而产生还原性含硫化合物,海洋中某些原生动物也在体内形成有臭味的还原性硫化物,以抵御捕食者的掠食。以上这些过程都向大气提供还原性硫化物。氧化性硫化物在大气中的主要形态有 SO2、SO3、H2SO4、MSO4。还原性硫化物在大气中被氧化的过程以及人为活动都产生大量 SO2,此后又通过 SO2→SO3→H2SO4→MSO4 的转化,使大气中硫化物通过酸雨或气溶胶复归地面。在这里,我们可以提出大气中硫的三种主要形态即:
H S、SO (SO 和 SO )和 SO 2-。很显然,大气中发生的化学变换,使它们彼
2 x 2 3 4
此相联,因而它们都是同一个循环的组成部分。讨论 SO2 的源与汇时,就不可避免地要与另外这几种大气含硫化合物相联系。大气中主要硫化合物的源和汇如图 2-21 所示。据估计,每年出入大气进行循环的硫量达 108 吨,其中
约 6.5×107 吨是由人为因素而进入大气的,其主要形态是 SO ,所以我们在以下叙述中将以 SO2 为中心展开讨论。
各种硫化物在大气中相互反应和转化的情况如图 8-12 所示。
就大气总体来说,SO 背景浓度约 0.2×10-9(V/V),上层大气及各地理区域空气中 SO2 浓度范围如图 8-13 所示。SO2 的最大天然源是 H2S。H2S 又来
源于火山爆发、硫酸盐生物还原、有机物腐烂等天然过程和各种工业废气(燃
料加工、人造丝、橡胶、硫化染料等行业)。H2S 在大气中很快被氧化为 SO2:
H S HO•→ HS O2 →SO O2 →SO
2 或NO 2
2
以上,HO·自由基从 H2S 中取得一个 H 原子的反应是全反应中控制速度的一步,速度常数为 6.4×104/s,由此计得 H S 在对流层中平均滞留时间为 16 小时。在溶液中(云中水滴)H2S 可被臭氧所氧化:
H2S+O3→SO2+H2O
化石燃料燃烧后产生烟气,这是大气中 SO2 的最大污染源。煤中一般含硫 0.1%~6%;重油 2%~5%,燃料油 0.75%~3%,原油~0.04%,柴油~ 0.22%。天然气和柴薪等含硫量少,SO2 污染问题也可能较轻微。
煤中硫主要以有机物和黄铁矿形态存在,也还有少量硫酸盐形态。不燃
 性硫酸盐最终以灰分形式排出。煤中含硫组分的约
95%最终也以 SO2 形态排出,还有少量
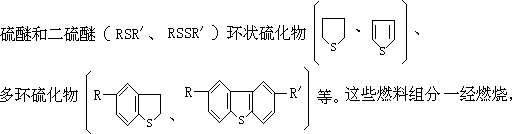
SO3。各种液体燃料中可能含有的硫化物有:硫醇(RSH)、
性硫酸盐最终以灰分形式排出。煤中含硫组分的约
95%最终也以 SO2 形态排出,还有少量
SO3。各种液体燃料中可能含有的硫化物有:硫醇(RSH)、
大部分转化为 SO2 向大气排出。也有少量在火焰中被进一步氧化为 SO3 排出, 或更进一步与水结合成 H2SO4,粘附在烟黑中形成所谓酸炭黑。
工业过程中 SO2 发生源主要有非铁金属冶炼、石油精炼、硫酸工业、炼铁、造纸等。
地面是大气中 SO2 的汇,SO2 在大气中转化为 SO3、H2SO4、MSO4 后以干或
湿的沉积物形态降落地面,这种转化主要通过以下两种途径发生:(1)气相中,主要氧化剂是 HO·自由基,氧化反应以较快速度进行,反应产物 SO3 溶于水生成 H2SO4。(2)液相中(即水滴),SO2 可被溶于水中的 H2O2、O3 等直接氧化,也可能在一些金属离子 Fe3+、Mn2+等存在条件下,很容易地被催化氧化后转为 H SO ,生成的硫酸进而在 NH +、Na+、Ca2+等离子存在下,再转
化为硫酸盐。当大气湿度较低时,水滴在空中蒸发后就剩下硫酸盐固体微粒。
