1. 水体中污染氰化物
================
1. 水体中氰化物来源和主要性质
氰化物在工业上有广泛用途,水体中氰化物主要来源于工厂排放的含氰废水,例如电镀废水、焦炉和高炉的煤气洗涤冷却水、选矿和矿石冶炼废水、合成纤维工业和某些化工行业废水等。
氢氰酸(HCN)是一种弱酸,其离解常数为 7.2×10-10。除了 HCN 外,在水中有最大溶解度的 NaCN 和 KCN 是水中氰污染物的常见形态。水中 CN-离子能与许多重金属离子形成络合物,这些络合物的稳定性有很大差别,锌、镉、铅与氰生成络合物最不稳定,铜氰络合物较稳定,银、金、镍、钴与氰生成非常稳定的络合物,由铁和亚铁与氰生成的络合物最为稳定,只在阳光照射下才发生少量分解。
水体对所受纳氰化物有较强自净作用,自净途径可能为:
- 氰化物的挥发 氰化物与酸性物质例如溶于水的 CO2 作用产生气态HCN 排向大气。
CN-+CO2+H2O→HCN+HCO3-
- 化学氧化和微生物分解水中氰化物可在细菌参与下,首先被溶解于水中的氧气氧化,然后通过细菌的作用继续分解到产生 NO3-或 CO2 为止:
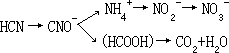
氰化物是剧毒物质,一般人只要一次误服 0.1 克左右氰化钠就会死亡,
敏感的人甚至口服 0.06 克就可致死。氰化物在体内抑制细胞色素氧化酶的正常功能,造成组织内部窒息。急性中毒者口中有苦杏仁味、恶心呕吐、头昏耳鸣、全身乏力、呼吸困难并出现痉挛等症状。氰化物对鱼类及水生生物等也具有极大毒性。利用 CN-与重金属离子可生成低毒络合物的性能,制成口服解毒剂。如碱性氢氧化亚铁制剂适用于实验室工作人员氰化物中毒之急救。
- 含氰工业废水治理方法
高浓度工业废水中的氰都以络合形态存在,故考虑含氰废水治理时一般应设法(如电解法)先使络合物分解,然后将金属用沉淀法等除去,余下氰化物再用各种方法使之转化为无害的 CO2、N2 等形态。对于含氰浓度较低的废水,其中必定含有部分自由态氰(CN-)且与络合态氰共处平衡状态,在用除 CN-法处理过程中,由平衡移动使络合物不断离解,处理过程得以继续进行。
- 碱性氯化法
碱性氯化法是化学氧化法之一种(另有电解氧化法、臭氧或过氧化氢氧化法以及活性炭催化氧化法等),也是处理含氰工业废水中最常用的方法。该法使用氯气作为处理药剂(也可用次氯酸钠溶液,因使用简便而被一些小厂采用),第一阶段的反应为:
 Cl2+H2O
HClO+HCl
Cl2+H2O
HClO+HCl
 CN-+ClO-+H2O
CNCl+2OH-
CN-+ClO-+H2O
CNCl+2OH-
产生高毒性的中间产物 CNCl 在碱性介质中进一步反应:
 CNCl+2OH-
CNO-+Cl-+H2O
CNCl+2OH-
CNO-+Cl-+H2O
这一阶段反应生成物 CNO-毒性很小且要求不高时,水处理到此即可终止,否则需作第二阶段处理。
在第二阶段反应过程中,CNO- 与过量 ClO- 在具备足够反应时间的条件下,最终转化为 N2 和 CO2。反应式为:
2CNO-+3ClO-→CO2+N2+3Cl-+CO32-
第一阶段的反应在高 pH 值下进行较为有利,所以废水在处理前先要用苛性钠将 pH 值调至 10.5~11,反应时间约 30 分钟至 2 小时。第二阶段的反应,则在略低的 pH 值下更有利,所以在反应进行前先用硫酸调 pH 值至 8.0~9.0, 反应时间约为 1 小时。应用本方法可使处理残液中含氰浓度降至 0.5mg/L。
- 臭氧氧化法
臭氧氧化时发生如下反应:
CN-+O3→CNO-+O2
2CNO-+3O3+H2O→2HCO3-+N2+3O2
臭氧氧化在碱性介质中进行较快,但碱性越强,臭氧消耗越多,因而采用弱碱性介质并连续调节 pH 值可使臭氧耗量降低。
臭氧氧化不产生污泥,无二次污染,能增加水中溶解氧和杀死病毒或细菌,从多方面达到改善水质的目的,但该方法操作费用较高。
- 综合回收法
综合回收法适合于高浓度含氰废水处理。
利用含氰废水在酸性条件下容易挥发出氢氰酸的特点,可对废水直接用水蒸气蒸馏,回收得到稀氢氰酸。
利用氢氰酸与铁屑和 K2CO3 溶液反应生成黄血盐的原理,可以处理和回收废水中所含的氰。反应式为:
4HCN+2K2CO3→4KCN+2CO2+2H2O
2HCN+Fe→Fe(CN)2+H2
4KCN+Fe(CN)2→K4Fe(CN)6
除上述三类方法外,近来还采用了生化处理法,该法的常用构筑物形式有塔式生物滤池、生物转盘、表面加速曝气池等,中间规模试验的结果表明, 应用本法氰去除率可达 95%。
- 水样中氰化物的分析方法
氰化物在水体中存在的形态是多样的。有简单的盐类,如钠、钾、铵的氰化物等,溶解度很大,毒性很强;也有复盐或铜、锌、铁、钴等络合物, 它们的物理化学性质和毒性也各不相同。一般称前者为“游离氰”,而所谓“总氰化物”是指除前者外还包括在测定条件下可产生 CN-的复盐和络合物的总和。
测定浓度在 1mg/L 以上时,用容量法为适宜,浓度低于 1mg/L 时,可采用比色法。
不管是容量法还是比色法,在测定前还需要将水样预先蒸馏,使氰化物以 HCN 形态蒸出,再经碱液吸收后,以待测定。水样中不同形态氰被蒸出的能力各异,所以不同蒸馏条件也将产生不同的最终分析结果。
水样中大多数形态的氰化物还是易被破坏的,所以采样后应尽早分析, 否则应向水样加 NaOH 溶液,使 pH 值提高到 11 以上并保存于阴凉处。
- 硝酸银容量法
在碱性溶液中,以试银灵(对二甲胺基亚苄基绕单宁)作指示剂,用 AgNO3 滴定,形成 Ag(CN)2-络合物,到达终点时,多余的银即与指示剂生成橙红色络合物,终点比较鲜明。
- 异烟酸-吡唑啉酮比色法
在中性条件下,水样中的氰离子先与氯胺 T 反应生成氯化氰,再与异烟酸作用,并经水解生成戊烯二醛,最后与吡唑啉酮进行缩合反应而生成蓝色染料。可应用 638nm 波长光进行比色测定。
-
水体中富营养污染物
- 水体富营养化问题
在湖泊、水库、河口、港湾等水流较缓的区域,最容易发生富营养化问题。这是一种由磷和氮的化合物过多排入水体后引起的二次污染现象。主要表现为水体中藻类大量繁殖,严重影响了水质。
在适宜的光照、温度、pH 值和具备充分营养物质的条件下,天然水体中藻类进行光合作用,合成本身的原生质,其总反应式可写为
106CO2+16NO3-+HPO42-+122H2O+18H++能量+微量元素
→C106H263O110N16P1+138O2
(藻类原生质)
从反应式可以看出,在藻类繁殖所需要的各种成分中,成为控制性因素的是磷和氮,所以藻类繁殖的程度主要决定于水体中这两种成分的含量,并且已经知道能为藻类吸收的是无机形态的含磷、氮的营养物。
藻类本身使水道阻塞,鱼类生存空间缩小,使水体生色,透明度降低, 其分泌物又能引起水臭、水味,在给水处理中造成各种困难。更重要的是富营养化还可能破坏水体中生态系统原有的平衡。藻类繁生将使有机物生产速度远远超过有机物消耗速度,从而使水体中有机物积蓄,其后果是:①促进细菌类微生物繁殖,一系列异养生物的食物链都会有所发展,使水体耗氧量大大增加;②生长在光照所不及的水层深处的藻类因呼吸作用也大量耗氧;
③沉于水底的死亡藻类在厌氧分解过程中促使大量厌氧菌繁殖;④富氨氮的水体开始使硝化细菌繁殖,在缺氧状态下又会转向反硝化过程。综合上述作用,富营养发生后,将先引起水底有机物消耗速度超过其生长速度,处于腐化污染状态,并逐渐向上层扩展,在严重时可使一部分水体区域完全变为腐化区。这样,由富营养而引起有机体大量生长的结果,倒过来又走向其反面, 藻类、植物及水生物、鱼类趋于衰亡以至绝迹。这些现象可能周期性地交替出现,一些湖泊、水库的沉积就是由此造成的。
