-
氮的循环
- 氮在自然环境中的循环
氮在各圈层中的浓度如下(括号内数字为元素的丰度次序): 地壳:20mg/kg(31)
海洋:溶解 N2,15.5mg/kg(11)
可溶性氮化合物,0.7mg/kg(17) 大气:75.53%(1)
 图
2-18
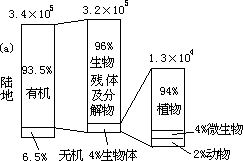
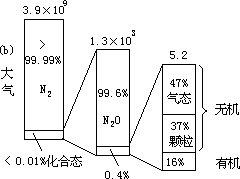
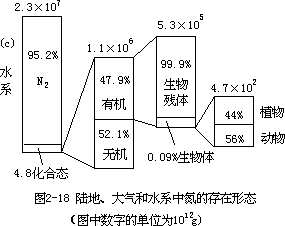
显示了陆地、大气和水系中氮的存在形态分布,由图可见,存在于陆地上的氮主要是分布在生物体内的有机氮,水系和大气中则都以分子氮为其主要存在形态。
图
2-18
显示了陆地、大气和水系中氮的存在形态分布,由图可见,存在于陆地上的氮主要是分布在生物体内的有机氮,水系和大气中则都以分子氮为其主要存在形态。
大气中分子态氮不像氧气那样具有高度的化学反应性,因此就不可能直接参与生物体内的元素循环。对于大多数需氮而又欠氮的作物,需要得到外来的含氮肥料才有可能正常生长。
氮分子之所以有化学惰性,是因为组成它的两个氮原子以三个共价键维
 系在一起:N≡N。要形成新的氮化物则需要外加
905kJ/mol
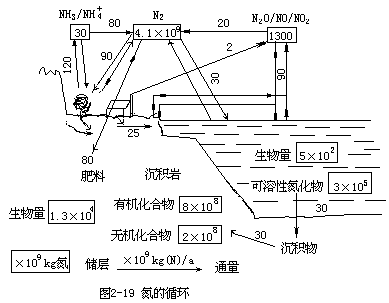
的能量,以使这三个键都发生断裂。对很多微生物说,它们却有能力越过这样高的能垒,使形成氮化合物的过程得以进行。所以在大多数情况下,只要具备其他必须条件(如充足的水分),则自然环境中发生的氮循环就能以足够大的速率来推动植物生长。氮及其化合物在环境中的循环及各不同价态化合物在循环中的转化等情况分别如图
2-19 和图 2-20 所示。
系在一起:N≡N。要形成新的氮化物则需要外加
905kJ/mol
的能量,以使这三个键都发生断裂。对很多微生物说,它们却有能力越过这样高的能垒,使形成氮化合物的过程得以进行。所以在大多数情况下,只要具备其他必须条件(如充足的水分),则自然环境中发生的氮循环就能以足够大的速率来推动植物生长。氮及其化合物在环境中的循环及各不同价态化合物在循环中的转化等情况分别如图
2-19 和图 2-20 所示。
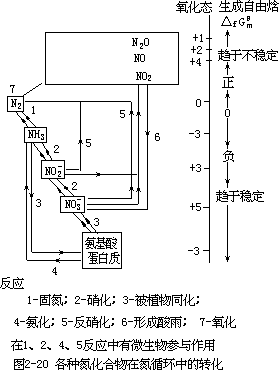
如图 2-20 所示,各种氮化合物的相对热力学稳定性可用生成自由焓值来度量。在氮循环中,由生物物质引起的反应起了主导作用,这些反应发生的次序为:
N2→NH3→NO2-→NO3-→氨基酸→蛋白质
相逆的过程,即返转到 N2 的反应,也可以在微生物存在下顺利地发生。
一般环境条件下,即便是无机氮化合物也不可能通过大气中氮经自发反应而生成。只是在高温条件下(例如天空打雷闪电,高温燃烧炉或汽车发动机内)才能生成各种氮氧化合物,它们在大气中又逐渐转变为硝酸盐,作为微生物生产硝酸盐的补充。
1914 年,德国人哈柏发明了合成氨的方法,从此开创了大规模氮肥工
业。据估计,世界范围内通过微生物作用全年固氮量约是 90×106 吨,而世
界氮肥产量可能已达 80×106 吨。由此可见,氮肥生产对世界粮食的逐年增产有着决定性意义。由于氮肥的使用,使这类化合物逐年散失在环境中,参与氮元素的生物地球化学循环。
以下对图 2-20 所示氮循环中的几个重要过程分别予以阐述。
