-
岩石风化和矿物溶解
- 风化过程
暴露于水、大气或有机物质中的岩石发生机械性、生物性或化学性消蚀的过程就是风化过程。这里所说的三类性质不同的消蚀作用往往是同时发生的。风化过程对于矿物和土壤的形成有着决定性的意义;天然水体中溶质种类、数量也和风化作用及随后的溶解过程密切有关。
单纯的化学风化包括溶解、水合、水解、络合、氧化等作用,这些作用往往是交叉重叠发生的。引起风化的主要环境因素有水、二氧化碳和氧气等。因为水无所不在,又有很强作用能力,所以成为风化作用中最主要的因素。表 4-7 所示为化学性因素引起的典型风化反应。在表中应用了高度简化和理想化的化学式来代表自然界存在的复杂矿物相,所列的某些反应还可经过中间过程,但未在化学计量方程式中表示出来。
表 4 — 7 典型风化反应举例
Ⅰ 同成分溶解反应:
SiO +2H O=H SiO
2(s) 2 4 4
石英
CaCO +H CO *=Ca2++2HCO - 3(s) 2 3 3
方解石
Al O · 3H O +2H O=2Al(OH) -+2H+ 2 3 2 (s) 2 4
三水铝矿
Ⅱ 异成分溶解反应:
Ca (PO ) F +H O=Ca (PO ) (OH) +F-+H+ 5 4 3 (s) 2 5 4 3 (s)
氟 磷 灰 石 羟 磷 灰 石
NaAlSi O +H CO *+9/2H O=Na++HCO -+2H SiO +Al Si O (OH)
3 8(s) 2 3 2 4 4 4 2 2 5 4(s)
钠 长 石 高 岭 石
7NaAlSi O +6H++20H O=6Na++10H SiO +3Na Al Si O (OH)
3 8(s) 2 4 4 0.23 2.23 3.67 10 2(s)
钠 长 石 钠 蒙 脱 石CaMg(CO ) +Ca2+=Mg2++2CaCO
3 2(s) 3(s)
白 云 石 方 解 石Ⅲ 氧化还原反应:
MnS +4H O=Mn2++SO 2-+8H++8e
(s) 2 4
3Fe O +H O+2e=2Fe O +2OH-
2 3(s) 2 3 4(s)
赤 铁 矿 磁 铁 矿
FeS +3(3/4)O +3(1/2)H 0=Fe(OH) +4H++2SO 2- 2(s) 2 2 3(s) 4
黄铁矿
PbS +4Mn O +12H O=Pb2++SO 2-+12Mn2++24OH- (s) 3 4(s) 2 4
方铅矿
Ⅳ 络合反应:
Al Si O (OH) +2Y-=2AlY+2H SiO +H O
2 2 5 4(s) 4 4 2
高 岭 石 ( 络 合 剂 )
异成分溶解(部分溶解)反应首先并主要地由晶格配位体或阳离子被交换引起。如氟磷灰石中的 F-可被水体中的 OH-所交换;甚至磷灰石中的一些PO43-基团在适当条件下也会被水中 CO32- 所代换。阳离子交换方式与此相类似,例如,存在于粘土矿物层间和表面的阳离子可与溶液中的阳离子进行交换,这种过程对改变天然水溶液组成有很大作用。
表 4-7 中列举的第Ⅲ类反应显示了由外界环境因素引起的氧化还原反应过程对 pH 值有显著的控制作用。例如,黄铁矿的氧化可生成氧化高铁和酸。随之,酸就会与岩石反应。另外金属氧化物,如 Fe2O3 和 Mn3O4 等的还原会产生大量的 OH-离子,这些离子作为配位体可以优先地“淋溶”出某些晶格组
分,从而加速了岩石的剥蚀。微生物和植物的生命活动对风化作用也会发生影响,可以认为是由于细胞分泌出有机络合剂的结果(如表 4-8 中第Ⅳ类反应)。
低分子量的水溶性有机酸阴离子,如草酸、苹果酸、丙二酸、醋酸、琥珀酸、酒石酸、香草酸和对-羟基苯甲酸等,可以认为是重要的络合剂。在上层土壤中这些络合剂的存在浓度可高达 10-5 到 10-4mol/L,其中草酸盐则是含量最多的。
风化作用在左右河水组成方面有很大意义。例如,河水中所含约 35%的Na+和大部分的 Ca2+分别来源于硅酸盐和碳酸盐的风化、溶解;所含 SO 2-的
约 60%来自于硫化物矿石的风化和硫酸盐矿物(石膏)的溶解;有约 1/3 数量的 HCO -也来自于碳酸盐矿石的风化。
- 矿物溶解
矿物种类繁多,溶解过程各不相同。以下仅举一个简单例子加以说明。在天然水系,特别是地下水体系中,方解石(CaCO3)的分解反应是经常发生的,其反应式为:
CaCO +CO +H O=Ca2++2HCO -
[Ca 2+ ][HCO − ]2
3 = K pco2
(4 − 27)
根据电中性条件,2[Ca2+]≌[HCO -],以上 K 表达式可以改写为
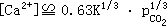
上式表明,方解石的溶解度随大气中 CO2 分压的立方根而增大。这类反应在土壤内的水-气体系中更容易发生,这是由于土壤中众多生物呼吸作用会使pCO2 比大气中的数值更大些的缘故。上式中平衡常数 K 可根据 CaCO3 的溶度积Ksp、H2CO3 的一级和二级酸电离常数 Kc1 和 Kc2 及 CO2 的亨利常数 KHC,应用下式予以计算:
K=K ·Kc ·K ·K -1 (4-28)
