能斯特方程及其电子活度表达式
NH +的氧化反应 NH ++2O →NO -+H O+2H+可被假想地看作为以下两半
反应之和:
1 NH+ + 3 H O → 1 NO − + 5 H + + e−
8 4 8 2
8 3 4
1 O + H + + e− → 1 H O
4 2 2 2
作为半反应平衡状态表征参数的电极电位 E,可用能斯特方程表示:
E = Eθ + RT ln [ 氧化形]
(4-35)
nF [ 还原形]
式中 E——平衡电极电位; Eθ——电极体系的标准电位; R——气体常数(8.314J/K·mol); T——热力学温度; n——电极反应中参加反应的电子数; F——法拉第常数(96487C);
[氧化形]
[还原形] ——表示参予电极反应所有氧化形物质浓度的乘积与还原形
物质浓度乘积之比,而且浓度的方次等于它们在电极反应方程中的系数。
在 25℃下,能斯特方程可写成:
E = Eθ + 0.0591 log [氧化形]
Eθ E
n [还原形]
取pEθ =
0.0591
和pE =
0.0591
,则上式可改写为
pE = pEθ + 1 lg[氧化形]
(4 − 36)
n [还原形]
从数值上看pE是E值的
负对数(见下文),即
1
0.0591
倍,从电化学含义来说,pE表示电子活度的
pE=-lg[e-] (4-37)
以上式(4-36)即是能斯特方程的电子活度表达式。用 pE 代替 E 并以此表示水体中氧化还原系统的平衡状态有其优越之处:①引用电子活度概念可使氧化还原平衡具有更明确的电化学含义;②一个天然水体系统其电子活度可在20 多个数量级范围内变化,使用 pE 参数可简化数字计算。
Eθ与反应平衡常数 K 及反应自由焓变△Gθ之间存在如下关系
△Gθ=- n EθF 和 △Gθ=-RTlnK
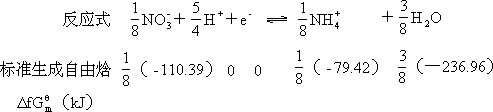 根据此二式,已知
Eθ、△Gθ和 K 三者之一,就可计得其余二者的数值。现以
NO -/NH +半反应为例,作计算如下。
根据此二式,已知
Eθ、△Gθ和 K 三者之一,就可计得其余二者的数值。现以
NO -/NH +半反应为例,作计算如下。
反应物和生成物的标准生成自由焓都可从热力学手册或附录三中查获。H+ 和e-的△fGmθ都被确定为零。
反应的自由焓变为
∆Gθ = 1 ( − 79.42
8
3
)+ 8 (
− 236.96) − 1 ( − 110.39) = -84.98kJ
8
根据△Gθ=-nEθF 式可计得 Eθ=0.88V。又根据上列△Gθ两表达式,可推出lgK=npEθ (4-38)
代入已知值,可计得 K=7.75×1014。至此,该半反应中各组分平衡浓度间关系式可写作
[NH+ ]1/8
lg 4 = npEθ = pEθ
[NO− ]1/8[H+ ]5/4[e− ]
取 pE=-lg[e-],代入上式可得
[NO− ]1/8 [H + ]5/4
pE = pEθ + lg 3
[ NH + ]1/8
此式与能斯特方程的电子活度表达式(4-36)相符,惟在此体系中电子迁移数 n=1。
在此还应该说明:①pE 与 pH 概念不同,pE 和 E 间的数值的关系不是负
对数的关系,而是pE = E / 2.3RT (25℃时,pE = E / 0.0591);②与pH值能
F
表示体系得失质子倾向这一点相似,pE 值能表示电对得失电子的倾向,即 pE 值越大,电子活度越低,氧化形相对浓度较大,有较强氧化性,容易从外界获取电子。若 pE 值越小,则情况正好相反;③按热力学定义,标准氢电极处于平衡时,介质中的电子活度为 1.0,则 pE=0.0。④在标准态(25℃,且电对各组分的活度皆等于 1)下,各电对氧化还原能力的相对强弱可用 Eθ或 pE
θ值的大小表征。以下列举环境水体中常见电对的氧化还原能力顺序(另见
附录九)。
强还原剂 弱氧化剂 E θ pE θ
CH COO- CO 0.075 1.27
3
H S SO 2- 0.303 5.12
4
|
Fe2+ |
Fe3+ |
0.771 |
13.03 |
|---|---|---|---|
|
NH + 4 |
NO - 3 |
0.882 |
14.91 |
|
H O 2 |
O 2(g) |
1.229 |
20.77 |
|
Cl- |
Cl 2(aq) |
1.391 |
23.51 |
|
弱还原剂 |
弱氧化剂 |
以 Eθ和 pEθ确定各电对氧化还原能力相对强弱后,同一体系中两电对间的反应按如下箭头所示方向进行:
强氧化剂+强还原剂→弱氧化剂+弱还原剂实例如下:2O2+NH4+→NO3-+H2O+2H+。
