汞及其化合物的基本性质
汞的元素丰度在地壳中占第 63 位(80μg/kg),在海洋中居第 40 位(0.15 μg/L),所以汞在各圈层中的储量及在各圈层间迁移通量都较小。
汞在周期表中与锌、镉两元素同处ⅡB 族。汞的化学性质、地球化学性质与镉比较相近,但与锌比却有较大差异。在与同族元素比较中,汞的特异性表现在:①氧化还原电位较高,易呈金属状态;②汞及其化合物具有较大挥发性。汞蒸气压随温度变化的数据如表 5-7 所示;各种无机汞化合物挥发性强弱次序为:Hg>Hg2Cl2 >HgCl2 >HgS>HgO;烷基汞化合物的饱和蒸气浓度为:CH HgCl(94mg/m3)、CH HgBr(94mg/m3)、CH HgI(90mg/m3)、CH HgOH
(10mg/m3)、C H HgCl(8mg/m3)、C H HgI(9mg/m3)。③单质汞是金属元
素中唯一在常温下呈液态的金属(mp=-38.9℃),具有很大流动性和溶解多种金属而形成汞齐的能力(如钠、钾、金、银、锌、镉、锡、铅等都易与汞生成汞齐);④能以 Hg2Cl2 一价形态存在;⑤与相应的锌化物相比,汞化合物具有较强共价性,且由于上述较强挥发性和流动性等因素,使它们在自然环境或生物体间有较大的迁移和分配能力。
表 5-7 汞的蒸气压
|
温度(℃) |
蒸气压(Pa) |
温度(℃) |
蒸气压(Pa) |
|---|---|---|---|
|
0 |
0.025 |
30 |
0.371 |
|
10 |
0.065 |
40 |
0.810 |
|
20 |
0.160 |
50 |
1.689 |
在 25℃温度下,元素汞在纯水中溶解度为 60μg/L,在缺氧水体中约为25μg/L。水溶性的汞盐有氯化汞、硫酸汞、硝酸汞和氯酸汞等;一些汞化合物的溶解度数据如表 5-8 所示:
表 5-8 一些汞化合物的溶解度
|
化合物 |
溶解度(g/100gH O) 2 |
温度(℃) |
溶度积(K ) sp |
温度(℃) |
|---|---|---|---|---|
|
HgBr 2 |
0.5 |
20 |
8×10-20 |
25 |
|
Hg Cl 2 2 |
3.8×10-5 |
25 |
2.0×10-16 |
25 |
|
化合物 |
溶解度(g/100gH O) 2 |
温度(℃) |
溶度积(K ) sp |
温度(℃) |
|---|---|---|---|---|
|
HgCl 2 |
6.1(g/100g 溶液) |
20 |
2.6×10-15 |
25 |
|
Hg (OH) 2 2 |
7.8×10-24 |
18 |
||
|
Hg(OH) 2 |
1×10-26 |
18 |
||
|
Hg S 2 |
5×10-45 |
25 |
||
|
HgS |
1.5×10-25 |
18 |
4×10-53 |
18 |
|
Hg SO 2 4 |
4.8×10-7 |
25 |
有机汞化合物中,乙基汞 Hg(Et)2 和EtHgCl 不溶于水,乙酸苯基汞PhHgAc微溶于水,乙酸汞 HgAc2 具有最大溶解度(0.97mol/L)。
Hg2+易在水体中形成络合物,配位数一般为 2 和 4;Hg 2+形成络合物的
倾向比 Hg2+小得多。在一般天然水体中,Hg2+可能与 Cl-形成相当稳定的络合物,在图 5-4 中显示了水体中 Hg 可能呈现的各种化学形态。在含[Cl-]< 10-5mol/L 的水溶液中,当 pH≥4 时,Hg2+以水解产物 Hg(OH) 为其主要存
在形态;在[Cl-]≈0.01mol/L 的水溶液中,则 Hg(OH)
为主要形态时的 pH
>6。
汞与水体中各种常见无机配位体的络合物稳定常数数据见表 5-9。
表 5-9 Hg2+与无机配位体生成络合物的稳定常数
|
配位体 |
稳定常数对数值 |
|||
|---|---|---|---|---|
|
K 1 |
K 2 |
K 3 |
K 4 |
|
|
Cl- |
6.72 |
6.51 |
1.00 |
0.97 |
|
NH 3 |
8.8 |
8.7 |
1.0 |
0.8 |
|
OH- |
10.3 |
11.4 |
汞还能与各种有机配位体形成稳定的络合物。例如与含硫配位体的半胱氨酸形成极强的共价络合物;与其他氨基酸及含—OH 或—COOH 基的配位体也都能形成相当稳定的络合物。汞离子和甲基汞离子形成各种有机络合物的稳定常数如表 5-
10 所示。此外,汞还能与微生物生长介质强烈结合,这表明 Hg2+能进入细菌细胞并生成各种有机络合物。
2+
Hg 和甲基汞与有机配位体生成络合物的稳定常数
|
配位体 |
K 的对数值 |
配位体 |
K 的对数值 |
||
|---|---|---|---|---|---|
|
CH Hg+ 3 |
Hg2+ |
CH Hg+ 3 |
Hg2+ |
||
|
-OH |
9.5 |
10.3 |
半胱氨酸 |
15.7 |
14 |
|
组氨酸 |
8.8 |
10 |
白朊 |
22.0 |
13 |
在酸性溶液中汞的电位图如下:
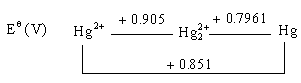
用金属汞或其他还原剂(其 Eθ值在 0.905V 与 0.851V 之间),可将 Hg
(Ⅱ)还原为 Hg(Ⅰ),反应平衡常数较大(K≈70),平衡强烈偏向于生成 Hg22+一方;若要反方向的歧化反应得以进行,则必须使 Hg2+变为难溶物或难离解的络合物(如 HgO、HgS、Hg(NH2)Cl、Hg(CN)2 等),从而减低溶液中 Hg2+的浓度。
汞的 E-pH 图如图 5-5 所示。从中可以看出,在变动的环境条件下,各种无机汞化合物的相对稳定状态。
