络合物的稳定性
络合物在水溶液中是否进行离解或进行分步离解为它的组成部分(水合的中心离子和配位体),也就是络合物在水溶液中的稳定性,是在此要讨论的主要内容。络合物在加热后是否容易分解,这关系到它的热稳定性;络合物在水溶液中是否容易发生质子传递反应,这关系到它的酸碱稳定性;络合物在水溶液中是否容易被氧化或者被还原,也就是它的中心离子的氧化态是否稳定,这关系到它的氧化-还原稳定性。以上是络合物表现在各个方面的稳定性。当有必要全面了解络合物的稳定性时,必须对以上各方面作综合考察。
- 络合物的稳定常数
关于络合物的各种稳定常数的定义如表 4-8 所示。表中的 K 是它们的逐
级稳定常数;β是累积稳定常数。水体中常见络合物的β值列于附录八中。
- 硬软酸碱(HSAB)原理
按路易斯的酸碱电子理论,凡是能接受电子对的分子、离子或原子团都是酸(也就是说,酸是电子对受体);凡能给出电子对的分子、离子或原子团都是碱(也就是说,碱是电子对给体)。
根据路易斯理论,金属络合物就是酸碱反应的产物。在这种反应里,配位基是路易斯碱,中心原子是路易斯酸。例如:
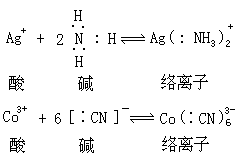
如果反应在水中进行,那么实际发生的是路易斯碱与溶剂水(也是碱)竞相和路易斯酸(金属正离子)结合的反应。这样 Co3+和 CN-在水中的反应应该写成
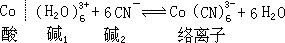
Ⅰ.单核络合物配位体递增
表 4 — 8 络合物稳定常数表达式
M L→ML L→ ML2 L→MLi L→ MLn
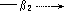 K1
K2 Ki K n
K1
K2 Ki K n
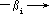
质子化配位体递增
Ki =
βi
[MLi ]
[ ML( i−1)][L]
= [MLi ] [M][L]i
(1)
(2)
M HL→ ML HL→ ML2Λ HL→ MLiΛ HL→ ML
* K1
*K2
*Ki
*K n
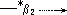
* [ MLi ][H+ ]
(3)
Ki =
( i−1)
][HL]
Ⅱ.多核络合物
* = [MLi ][H+ ]i
i [M][HL]i
(4)
在β 和*β 中,下标符号 n 及 m 指生成的络合物 M L 的组成(如 m=1,则 1 可省略)。
nm nm m n
βnm
= [MmLn ] [M]m[L]n
(5)
* = [MmLn ][H+]n
nm [M]m[HL]n
(6)
1963 年皮尔逊根据实验观察,陈述了如下的硬软酸碱原理:硬碱优先与硬酸配位,软碱则优先与软酸配位。
应当指出,硬和软并不等同于强和弱。酸碱的硬软分类也不是绝对的, 就像键的类型一样有一个连续的过渡(从共价键经极性键到离子键),我们在这里也有一个与之相当的连续过渡,即从很软的酸碱到很硬的酸碱。一般地说,硬酸的受体原子体积小,有较高正电荷,并且没有容易被扭变或可被除去的价电子。软酸的受体体积大,具有较小的正电荷,或者含有几个容易被扭变或可被除去的价电子。硬碱具有较小极化率、较大电负性和电子亲和能,以及不易受氧化的性能,也就是说,它能较紧密地保持它的价电子。软碱则具有正好相反的性质。
表 4 — 9 水体中常见的软硬酸碱
|
硬酸 |
软酸 |
|---|---|
|
H+,碱金属离子、碱土金属离子Mn2+,Al3+,La3+,Co3+ Fe3+,Ti4+,Sn4+ |
Cu+,Ag+,Au+,Tl+,Hg+ Cd2+,Hg2+ |
中 间 酸 Fe2+,Co2+,Ni2+,Cu2+,Zn2+,Pb2+,Sn2+
|
硬碱 |
软碱 |
|---|---|
|
F-,O2-,OH-,H2O,Cl-, |
R S,RSH,SCN-,S O 2-,S2- 2 2 3 |
|
CH COO-,NO -,ClO -,SO 2- 3 3 4 4 |
R P,(RO) P 3 3 |
CO 2-,PO 3-, 3 4 |
I-,CN-, |
|
ROH,R O |
|
|
2 |
中间碱
Br-,NO -,SO 2-,吡啶2 3
可用如下表达式中的σa。σb 参数分别表征酸和碱的软硬度
∑I
σa =
- E
− (−∆Hθ ) n
+ ∆Hθ
(4 − 31)
σ = A h b n
(4 − 32)
上两式中 Ip——电离能;
n—— 电 荷 数 ; EA——电子亲和能;
∆Hθ——溶剂化能。
σa 和σb 越大表示该酸或碱越软,否则反然。
表 4-9 列举了经分类后的各种硬软酸碱,这种分类是很粗略的,因为迄今还不具备足够的实验数据可供细致地进行酸碱软硬分类之用。
