海洋
海洋覆盖着 70.8%的地球表面,总面积约 361×1012m2(图 3-3),平均深度 3800m,所以总体积为 1370×1015m3。
海水有很大含盐量,离子强度 I~0.7,表现出强电解质溶液性质。表 3-2 列举和比较了海水和纯水的各种物理性质。相比之下,海水具有冰点下降特性,且有很大的密度、电导率、折光率、渗透压等。
温度和盐度是决定海水各种性质的决定性因数。海洋中的温度和盐度随深度而变化的情况如图 3-4 所示,同图还显示了溶解氧浓度及浅水区光透过度与深度之间的关系。海洋表层盐度因海域、降水、蒸发、结冰和融冰等因素而异;表层温度在太阳辐照的日变化和年变化影响下也会发生显著变化。但因水体热容量大,所以温度变化幅度比陆地小得多。就总体来说,海水中盐度可能达到 35‰、平均温度不超过 4℃、光透过性大约是数十米。海洋表层是富氧的,这起因于大气氧的补充和海中浮游生物的光合作用。在深水地区直到海底氧含量很低又很均一。
表 3 — 2 水和海水物理性质比较
|
性质 |
单位 |
水 |
海水(盐分, 35 ‰) |
|---|---|---|---|
|
密度( 20 ℃) ( 0 ℃) 容积压缩率 ( 0 ℃, 107Pa ) ( 0 ℃, 108Pa ) 音速( 20 ℃) 折光率( 20 ℃) 电导率( 20 ℃) 比热( 20 ℃) 表面张力( 20 ℃) 粘度( 20 ℃) 渗透压( 20 ℃) 冰点 波长520nm 吸光度 光程10cm |
g · cm-3 |
0.9823 |
1.02478 |
|
g · cm-3 |
0.9987 |
1.02812 |
|
|
% |
0.487 |
0.458 |
|
|
% |
4.007 |
||
|
m · s-1 |
1482.7 |
1522.1 |
|
|
— |
1.33300 |
1.33940 |
|
|
m Ω-1 · cm-1 |
4.5 × 10-5 |
47.88 |
|
|
J · g-1 |
4.182 |
3.993 |
|
|
10-3N · m-1 |
72.76 |
73.53 |
|
|
10-3Pa · s |
1.005 |
1.092 |
|
|
105Pa |
— |
24.8 |
|
|
℃ |
0.00 |
-1.91 |
|
|
— |
0.002 |
0.007 (人工海水) |
|
|
0.008 (外洋水) |
海水 pH 值在表层为 8.1~8.3,在深层可下降到 7.8。海水中溶解着大量盐类和气体,化学组成非常复杂,几乎包含了周期表中所有的元素。有关海水化学组成问题在此只能作一简述。溶解于海水中的物质按它们存在的数量可分为三类,即主要离子、少量物质和微量元素。占溶质总量 99%的主要成分(表 3-3)依次为 Cl-、Na+、Mg2+、SO42-、Ca2+、K+和(HCO3-+CO32-)。由于各大洋水流相通,而且混合充分,因此这些主要离子中除(HCO3-和 CO32-) 浓度变动较大外,其他离子的相对比例基本上是恒定的(但并不排除海水组成在水平和垂直方向上有规律的一定变化)。因此可通过含氯量来推算其他主要组分在海水中的浓度。
|
成分 |
平均化学组成( mol/kg ) |
成分 |
平均化学组成( mol/kg ) |
|
|---|---|---|---|---|
|
海水 |
河川水 |
海水 河川水 |
||
|
Na+ |
0.46847 |
2.83 × 10-4 |
Cu |
10-8 |
|
K+ |
0.01020 |
5.9 × 10-5 |
Zn |
10-8 |
|
Mg2+ |
0.05307 |
1.69 × 10-4 |
Cd |
10-8 |
|
Ca2+ |
0.01028 |
3.74 × 10-4 |
Mn |
10-8 |
|
Cl- |
0.54590 |
2.20 × 10-4 |
Hg |
10-9 |
|
SO 2- 4 |
0.02823 |
1.17 × 10-4 |
Ni |
10-8 |
|
Alk ① |
0.0024 |
9.54 × 10-4 |
Co |
10-9 |
|
Cr ② |
0.0022 |
1.02 × 10-3 |
腐植质 |
10-6 |
|
pH |
7.5 |
8.2 |
① Alk (碳酸盐碱度和重碳酸盐碱度)=[HCO -]+2[CO 2-]。
3 3
② Cr (总无机碳)=[H CO *]+[HCO -]+[CO 2-]
2 3 3 3
含氯量包括水样中氯化物、溴化物和碘化物总和(后两者被折算为氯化物)。盐度和含氯量之间的经验关系式为
盐度‰=0.03+1.805(含氯量‰) (3-1)
盐度在此被定义为在水样中所有碳酸盐转化为氧化物,所有溴化物和碘化物被转换为氯化物以及所有有机物被氧化后计得的水中总固体物浓度。
海水中主要组分的最基本化学参数(离子对离解常数和活度系数)如表3-4 所示。由这些数据出发,可通过组建化学模型以计算法求得这些组分在
海水中相互结合的形态分数。计算结果如表 3-5 所示。由此可见,表列的四种阳离子和 Cl-阴离子在海水中很大程度甚至全部呈自由离子状态存在; CO 2-、SO 2-、HCO -则可与阳离子形成离子对,且各自的离子对形成能力依次
递减。
表 3-4 25 ℃、常压下海水中主要组分和离子对的离解常数( pK )和活度系数①
|
HCO -( 0.68 ) 3 |
CO 2-( 0.28 ) 3 |
SO 2-( 0.2 ) 4 |
|
|---|---|---|---|
|
K+ ( 0.64 ) Na+ ( 0.76 ) |
— -0.25 ( 1.13 ) |
— 1.27 ( 0.68 ) |
0.97 ( 0.68 ) 0.72 ( 0.68 ) |
|
Ca2+( 0.28 ) |
1.26 ( 0.68 ) |
3.2 ( 1.13 ) |
2.31 ( 1.13 ) |
|
Mg2+( 0.36 ) |
1.16 ( 0.68 ) |
3.4 ( 1.13 ) |
2.36 ( 1.13 ) |
①括号外数字为 pK 值,括号内数字为活度系数值;设定含氯量为 19 %。
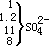
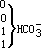
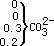 表
3 — 5 海水中主要元素存在形态的百分比
表
3 — 5 海水中主要元素存在形态的百分比
|
主要组分离子 |
重量摩尔浓度 |
自由离子(%) |
离子对(%) |
|---|---|---|---|
|
K+ |
0.010 |
99 |
|
|
Na+ |
0.48 |
99 |
|
|
Mg2+ Ca2+ |
0.054 0.010 |
87 91 |
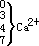
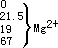
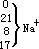
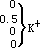
CO 2- 0.00027 9
3
关于海水中的微量金属离子的存在形态问题,由于这些离子大多会发生水解或与 Cl-、SO 2-、CO 2-等配位体形成各种络合离子,且其存在形态还受
水域深度、氧化还原电位、生物浓集等因素影响,所以情况要比常量离子复杂得多。虽然在具备必要的数据基础上也能类似常量离子那样作计算处理, 但需要再经分析手段予以验证。可以想见,有关这方面的分析技术也有着相当的难度和复杂性。
对海水中溶解性有机碳(DOC)的确切组成尚不了解,其浓度一般为 1~ 5mg/L,近海岸处可能达到 20mg/L,而在 300 米以下深处可降低至 0.5mg/L。表 3-6 列举了各种海水中 DOC 的典型数据。为了比较,将河水的数据也一并列入。
表 3-6 海水和河水中 DOC 浓度( mg/L )
|
系统 正常值 最高值 |
系统 |
正常值 |
最高值 |
|---|---|---|---|
|
海湾 1 ~ 5 20 海滨 1 ~ 5 20 表面海水 1 ~ 1.5 ─ |
深层海水 |
0.5 ~ 0.8 |
— |
|
河水 |
10 ~ 20 |
50 |
显然,海洋是一个开放系统,它时刻与外系统间发生物质和能量的交换。例如,每年有 3.3×1013~3.8×1013m3 的水由河流流入海洋,其中带入溶解盐类有 38.5 亿吨,悬浮物有 32.5 亿吨。此外在海洋-大气、海洋-海底间也都发生着物质和能量往返传输和交换的过程。在大气和海洋交界的海面能生成微粒气溶胶,湿度较高时,颗粒较大;湿度低时,可呈干的海盐微粒。这些颗粒物可经大气对流或风力运送达到数千米高空或内陆地区,在大气降水形成过程中起凝结核作用。这些颗粒物的化学组成与海水有很大差异,这是因为:①海面上水泡破裂形成水滴时,因各种气象因素作用,其成分已与海水相异;②海水滴蒸发干涸时,其中容易结晶的组分率先析出分去,结果成为两颗或两颗以上化学组成和性质相异的粒子。
有关海洋污染问题约有以下几个主要方面:
- 由汇入海洋的河水夹带的工农业废水以及投弃海洋的各种工业废
物;
-
在由河水夹带入海的生活污水中含有很丰富的营养物质,可在河口、海湾地区引起赤潮;
-
依傍海岸建立的核电站、热电站排水中的放射性污染物和热污染;
-
由运输船只机房排出的机油,由海难事件中油轮倾翻的大量原油;
-
各种塑料制件(破碎鱼网、船上丢弃入海的废塑料制品);
-
由旅游事业引起的海滨地区污染等。
