5.6 水体中重金属污染物——铅
- 铅及其化合物的基本性质
铅在地球上属分散元素,它的元素丰度在地壳中占第 35 位(13mg/kg), 在海洋中居第 46 位(0.03μg/L)。
铅是淡黄带灰的柔软金属,切削面有金属光泽,但在空气中很快生成黯灰色氧化膜。铅是除金和汞之外常见金属中最重的金属,它容易机械加工、熔点低、密度高、又能抗腐蚀,这些优良性质使它获得了广泛的应用。
铅在活泼性顺序中位于氢之上,能缓慢溶解在非氧化性稀酸中,也易溶于稀 HNO3 中,加热时溶于 HCl 和 H2SO4;有氧存在的条件下,还能溶于醋酸, 所以常用醋酸浸取处理含铅矿石。
易溶于水的铅盐有硝酸铅、醋酸铅等。但大多数铅化合物难溶于水,如硫化物、氢氧化物、磷酸盐、硫酸盐等皆为难溶铅盐,它们的溶解度数据如表 5-15 所示。作为汽车排气的一种重要成分,PbxClyBrz 在水中有较大溶解度,而且溶解度数据是一个十分重要的环境参数,它关系到空气中含铅化合物的湿降、土壤中含铅化合物的溶解迁移等环境过程,也关系到沉积在人体肺内铅化合物的生理特性等。PbxClyBrz 在水中溶解度数据如表 5-16 所示。这些卤化物的溶解度数据也可根据热力学关系式进行计算求得。
表 5-15 能溶铅化合物的溶解度
|
化合物 |
溶解度(g/100gH O) 2 |
温度 (℃) |
溶度积(K ) sp |
温度 (℃) |
|---|---|---|---|---|
|
PbCO 3 |
4.8×10-6 |
18 |
3.3×10-14 |
18 |
|
PbCrO 4 |
4.3×10-6 |
18 |
1.8×10-14 |
18 |
|
Pb(OH) 2 |
2.8×10-16 |
25 |
||
|
Pb (PO ) 3 4 2 |
1.3×10-5 |
20 |
1.5×10-32 |
18 |
|
PbS |
4.9×10-12 |
18 |
3.4×10-26 |
18 |
|
PbSO4 |
4.5×10-3 |
18 |
1.1×10-8 |
18 |
表 5-16 Pb CI Br 在水中的溶解度
x y z
|
温度(℃) |
化合物 |
溶解度(g/L) |
溶解度(mol/L) |
|---|---|---|---|
|
PbC1 2 PbBr 2 PbBrCl PbC1 2 PbBr 2 PbBrCl PbCl 2 PbBr 2 PbBrCl |
14.5 |
5.21×10-2 |
|
|
40 |
15.3 |
4.17×10-2 |
|
|
9.55 |
2.96×10-2 |
||
|
9.9 |
3.56×10-2 |
||
|
20 |
8.5 |
2.31×10-2 |
|
|
6.64 |
2.06×10-2 |
||
|
6.73 |
2.42×10-3 |
||
| 0 |
4.55 |
1.24×10-3 |
|
|
4.38 |
1.36×10-3 |
铅在周期表中位于第Ⅳ族。原子外层轨道有四个价电子,其中两个是 s 电子,另两个是 p 电子。所有四个价电子很难从原子中完全失去,而常与电负性较大元素的原子共用电子,形成共价键。在许多铅的化合物中,两个 s
价电子不参加成键,而是作为稳定的电子对与原子实相结合着,此时,铅表现出+2 氧化态。由于四价铅具有高氧化性,所以也可以说+2 氧化态是它的特征氧化态,二价化合物比四价更稳定。此外铅还可能有+1 和+3 氧化数。在简单化合物中,只有少数几种+4 价化合物(如 PbO2)是稳定的。
含铅的盐类多能水解。铅的氢氧化物有二性,既能形成含有 PbO 2- 和PbO 2-的盐,又能形成含有 M4+和 M2+的盐。这两种形式的盐都能水解。由于H2PbO3 和 H2PbO2 都是弱酸,碱金属铅酸盐在水溶液中呈强碱性,而亚铅酸盐
在水溶液中更能发生强烈水解作用。PbCl4 之类的四价铅盐在水溶液中也强烈
水解而产生 PbO2。
水溶液中,铅与配位体反应时,显示出介于硬酸和软酸之间的性质。铅与一些无机配位体生成络合物的稳定常数如表 5-17 所示。由表列数据可见,Pb2+与 OH-配位体生成 Pb(OH)+的能力比与 Cl-配位体络合的能力大得多,甚至在 pH=8.1~8.2,[Cl-]=20000mg/L 的海水中,Pb(OH)+的形态还能占据优势;在 pH>6 时,Pb3(PO4)2 和 PbSO4 等难溶盐也会发生水解生成可溶性 Pb(OH)+;在 pH<10.0 的条件下,不会形成 Pb(OH) 沉淀。
表 5-17 铅无机络合物的稳定常数
|
配位体 |
logβ 1 |
logβ 2 |
logβ 3 |
logβ 4 |
|---|---|---|---|---|
|
Cl- |
1.6 2.7 6.2 2.9 7.5 |
1.78 3.47 10.9 — — |
1.68 — 13.9 — — |
1.38 — 16.3 — — |
|
SO 2- |
||||
| 4 | ||||
|
OH- |
||||
|
HCO - |
||||
|
3 |
||||
|
CO 2- |
||||
| 3 |
铅还能与含硫、氮、氧原子的有机配位体生成中等强度螯合物。铅的氧化还原电位图如下:
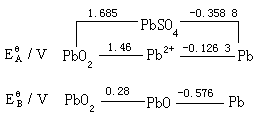
Pb(Ⅳ)有较强氧化性,如 PbO2 在酸性介质中可以把 Cl-氧化为单质氯,还可以将 Mn2+氧化成紫红色的 MnO4-。
与同族元素碳、硅相比,铅的金属性强,共价性显著降低,在许多碳、硅化合物中,相同原子能联结成键,铅则不能。所以含铅有机化合物的数量不多,且有机铅化合物的稳定性也较差,如烷基铅加热时就能分解,这就证明了 C—Pb 间的键力很弱。各种铅有机化合物的稳定程度由分子中有机基团性质和数目决定,一般芳基铅化合物比烷基铅化合物稳定,且随有机基团数增多,稳定性提高。
烷基铅是一类重要的有机铅化合物。四甲基铅在常温下是密度为 1.9952
(20℃)的无色、带芳香的油状液体,沸点 110℃,可溶于苯、醇、醚而不溶于水。四乙基铅(C2H5)4Pb 在常温下是密度为 1.6600(18℃)的无色、带特殊臭气的油状液体,沸点 199℃,可溶于苯、醚、微溶于乙醇而不溶于水。这两种化合物还能以任何比例与汽油互溶。在含铅汽油中,这类烷基铅被用作抗震剂。
某些 Pb2+化合物(如乙酸铅)在厌氧条件下能生物甲基化而生成(CH )
Pb,反应条件为:①Pb2+浓度控制在 1~10μg/mL;②含 S2-浓度不能太高以
免生成 PbS;③培养液使用期不超过 6~7 周。在上述条件下,反应速率约 2.5 μg/d,且实验室内进行的生物甲基化试验有很好的重现性。将含铅的水底沉积物在恒温箱中保存一段时间之后,也会产生(CH3)4Pb。
(CH3)2PbX2 能在环境条件下发生不可逆歧化反应, 2(CH3)2PbX2→(CH3)3PbX+PbX2+CH3X
X 的种类和反应物浓度不影响反应的化学计量性;反应是一级的,随反应物浓度增大,反应速率加快;X 的种类对反应速率的影响按下列次序递增:
Ac-<ClO -<NO -<Cl-<NO -<Br-<SCN-<I-。
(CH3)3PbX 也能发生歧化反应,
3(CH3)3PbX→2(CH3)4Pb+PbX2+CH3X 歧化反应进行很慢,X 的种类对反应速率的影响也较小。
