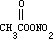光化学氧化剂
大气光化学氧化剂包括 O3、PANs、NO2、H2O2、HNO3 等。本节内容主要涉及前二者。它们都是光化学烟雾的组成物。
- 臭氧(O3)
臭氧是大气中普遍存在的氧化剂,它在对流层中平均浓度约 1.7×10- 9mol/L。在汽车、燃煤电厂、石油化工厂等排气中含有 NOx,并可由其通过进一步光化学过程产生 O3,随后又容易导致光化学烟雾的发生。除此之外,对流层中臭氧还来源于以下几个方面:①从平流层扩散而下;②工程电器和民用电器设施高压放电;③自然界雷雨时节闪电等过程中,大气中部分氧气转为 O3;④森林地区空气中含少量 NO2、HCHO、萜烯等,由光化学反应生成 O3;
⑤化学工业中将 O3 作为强氧化剂,以代替高温氧化、催化氧化。也可作为纤维织物的漂白剂、脱臭剂,或作水处理净化剂等。在应用过程中可能有部分O3 散逸到大气中去。
对流层大气中的臭氧又是主要地通过均相光化学反应和非均相氧化反应消除。与臭氧层中情况相似(参见 7.8.1),均相光化学反应包括 ClOx、NOx 和 HOx 环式反应。此外,如下式所示的气相反应也是对流层中 O3 的主要汇:
O3+H2O(g)+hv→O2+2HO·
非均相反应是空气中 O3 先溶于水,然后氧化 S(Ⅳ)和 NOx 的反应(参
见 8.7.3),其氧化速率与大气中 O3 浓度成正比。估计通过非均相反应消除的量约为臭氧汇总量的 1/3。
臭氧是最强的氧化剂之一,它的某些物理性质列于表 8-24。臭氧分子 O3
呈三角形,键角为 116.8°,键长 127.8pm。O3 的分子结构型式与 SO2 分子类同(见 8.6.2)。在 O3 分子中没有单电子,所以分子是反磁性的。
表 8-24 臭氧的物理性质
|
外观 |
无色,有鱼腥臭味 |
临界温度(℃) |
-5 |
|---|---|---|---|
|
相对密度(以空气为 1) |
1.658 |
凝固点(℃) |
-192.7 |
|
蒸汽密度 (25 ℃, |
1.96 |
沸点(℃) |
-111.9 |
|
101.3kPa)(g\L) |
|||
|
溶解度(ml/100ml 水) |
0.494 |
通常,臭氧在空气中浓度很低,但在光化学烟雾发生过程中,经有烯烃类参与的各种反应,使臭氧浓度很快升高。在此用“光化学臭氧生成能力
(POCP)”大小来衡量烃的反应性,并取乙烯的 POCP=100 作为参照。烯烃类和富电子分子一般有较大 POCP 值,参见表 8-25。
表 8 — 25 烃类化合物的 POCP 值
|
化合物 |
POCP |
化合物 |
POCP |
化合物 |
POCP |
|---|---|---|---|---|---|
|
烷烃 |
烯烃 |
对二甲苯 |
90 |
||
|
甲烷 |
1 |
乙烯 |
100 |
1,2,4-三甲基苯 |
120 |
|
乙烷 |
10 |
丙烯 |
105 |
氧代烃 |
|
|
丙烷 |
40 |
1-丁烯 |
95 |
甲醛 |
40 |
|
正戊烷 |
40 |
2-丁烯 |
100 |
乙醛 |
55 |
|
异戊烷 |
30 |
1,3-丁二烯 |
105 |
丙烯醛 |
120 |
|
正己烷 |
50 |
异戊二烯 |
100 |
苯甲醛 |
-35 |
|
2,3-二甲基丁烷 |
40 |
芳香烃 |
丙酮 |
20 |
|
|
环烷烃 |
苯 |
20 |
乙醇 |
25 |
|
|
环戊烷 |
50 |
甲苯 |
55 |
氯代烃 |
|
|
甲基环戊烷 |
50 |
邻-二甲苯 |
65 |
二氯甲烷 |
1 |
|
环己烷 |
25 |
间-二甲苯 |
105 |
氯仿 |
1 |
O3 与烯烃作用的反应通式如下:
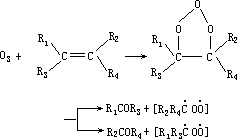
经产生臭氧加成物后,反应的初级生成物是羰基化合物和具双自由基的克里奇中间体,后者具有较高能量,有可能发生分解或结构重排而得到新的产物,也可能经“热化”后再与醛、SO2、H2O 等发生如下反应:
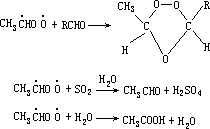
空气中过高浓度臭氧对植物是有害的,对 O3 感受灵敏的有番茄、豆类、烟草等。在臭氧作用下植物表面或树叶显现斑点。作为强氧化剂,O3 能使橡胶、织物等褪色、开裂,缩短它们的使用寿命;对人的眼、鼻、咽喉等产生刺激,影响肺部正常功能,更高浓度 O3 会导致动物生命缩短。
- 过氧酰基硝酸酯(PANs)
前已述及,PANs 是一类化合物,但目前还只能使用气相色谱法(GC-ECD) 对此类化合物之一的过氧乙酰硝酸酯(PAN)进行大气监测,也只是对这一化合物的性质(见表 8-26)略有所知。
表 8-26 过氧乙酰硝酸酯( PAN )的物理性质
|
化学式 物理状态(25 ℃,101.3kPa) |
无色液体 |
沸点 室温时蒸气压 |
达到沸点前分解 ~ 2000Pa |
PAN 没有天然源,只有人为源,即全部由初生污染物通过反应产生,因此测得大气中有 PAN 即可作为发生光化学烟雾的依据。PAN 通常由大气中乙醛和氮氧化物反应生成:
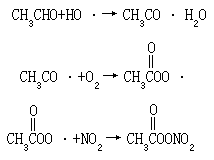
PAN 的主要的汇是热分解反应,产物为 CH3COOO 和 NO2。
- 分析方法
从分析测定目的出发,一般将光化学氧化剂分为三类:总氧化剂、臭氧和过氧乙酰硝酸酯。后两者都能分别测定,而总氧化剂通常作为一类化合物来测定。
分析测定总氧化剂时,将气体试样通过中性缓冲碘化钾溶液(NBKI), 该吸收剂能与 O3、NO2、PAN 反应后析出 I2,然后在 352nm 下比色定量;或者用淀粉溶液显示蓝色,在波长 575nm 下比色定量。
分析测定臭氧可用化学发光法,这是由世界卫生组织和很多国家组成全球监测系统所制订的标准方法。其工作原理是基于臭氧和乙烯在气相反应中能发生光子的事实。反应式如下:
2O +2C H →4HCHO*+O
HCHO*→HCHO+hv
光子被光电倍增管接受,转为电流,再经放大后被测量。电流大小与臭氧浓度成正比。
测定过氧乙酰硝酸酯通常用带有电子俘获检测器的气相色谱仪,检测限可达 0.5μg/m3。
- 光化学烟雾形成机理
图 8-20 所示是光化学烟雾形成机理的概略图。这是一个大大简化了的图像,12 个反应只是代表了其中最重要的反应,而相当多数量的次要反应或不十分确定的反应都略去了。此外,有一些反应产物在图中也没有表现出来(如CO、CO2 等)。尽管如此,通过对此图的分析,我们还是能够大体了解光化学烟雾的生成机理,而且还能启发我们寻求防治和监测光化学烟雾的方法。例如设法减轻 NOx 和烃类对大气污染,能避免光化学烟雾的发生;又如对大气中 O3、PAN 浓度进行连续、实时监测,就能判断大气受光化学烟雾污染的程度。
对于图中标出的 12 个反应列举如下:
(1)NO2+UV→NO+O
(2)O+O2→O3
-
O+CxHy→CxHyO·
-
O3+NO→NO2+O2
-
O2+CxHyO·→CxHyO3·
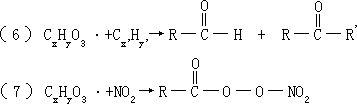
-
CxHyO3·+NO→CxHyO2·+NO2
-
CxHyO3·+O2→CxHyO2·+O3
-
CxHyO2·+NO→NO2+CxHyO·
-
SO2+O→SO3
-
SO3+H2O→H2SO4